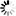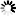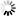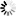摘要:來自牛津大學生命科學學院的Ciulli教授和他的團隊開發的降解分子現在在世界各地被用于尋找癌癥、皮膚病和神經系統疾病等疾病的新療法。
鄧迪大學(University of Dundee)發現的一種突破性的分子膠,可能為新一代針對癌癥和神經退行性疾病的藥物鋪平道路。
由Alessio Ciulli教授領導的大學靶向蛋白質降解中心(CeTPD)的一個研究小組,與維也納奧地利科學院分子醫學研究中心(CEMM)的Georg Winter博士的研究小組合作,已經定義了一種新的所謂的“分子內二價膠”,它可以結合蛋白質-對細胞至關重要,使我們的身體正常運作-否則就會分開。
這項研究發表在《自然》雜志上。
 圖1 分子內二價膠靶向降解蛋白質
圖1 分子內二價膠靶向降解蛋白質鄧迪大學CeTPD主任Alessio Ciulli教授說:“這些發現對整個從事靶向蛋白質降解的制藥行業具有重大意義。”
“對于針對癌癥、神經退行性疾病和許多由蛋白質驅動的疾病的藥物開發來說尤其如此,這些疾病一直被認為是不可藥物的。
“蛋白質對我們的細胞正常運作至關重要,但當這些蛋白質不能正常工作時,身體就容易生病。”
“我們已經能夠定義的膠水是特殊的,因為它首先在兩個地方附著在一個蛋白質上,而不僅僅是一個,然后招募第二個蛋白質,有效地將兩個蛋白質夾在一起。”
“我們只能通過我們的靶向蛋白質降解技術來識別這一點,并且已經確定了一個漏洞,可以通過設計新藥來利用,這些新藥可能會改變癌癥患者和其他無法治愈的疾病的治療方法。”
靶向蛋白降解(Targeted protein degradation, TPD)是一個新興的治療疾病的藥物開發領域,它涉及到重定向細胞中的蛋白質循環系統來破壞致病蛋白質。大多數TPD策略使用小分子——所謂的降解物——將這些目標蛋白招募到一類被稱為泛素E3連接酶的酶上。E3用泛素標記靶蛋白,最終通過細胞廢物箱——蛋白酶體破壞致病蛋白。
Dundee團隊與CEMM、法蘭克福歌德大學(Goethe University of Frankfurt)和日本制藥公司衛材(Eisai Co. Ltd)的合作者合作,揭示了一種不同于先前已知的分子粘合的新機制。這種新機制與目標蛋白的兩面結合,而不僅僅是一面,促使整個蛋白的重排,并穩定了其與E3連接酶之前未知的相互作用。
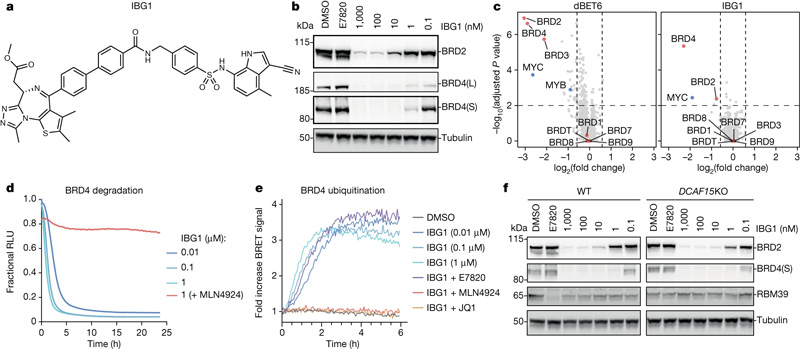 圖2 IBG1獨立于DCAF15降解BRD2和BRD4
圖2 IBG1獨立于DCAF15降解BRD2和BRD4此外,該團隊首次能夠可視化他們的化合物工作的精確機制,并將目標蛋白結合到這些E3連接酶之一上。因為這些分子有兩個頭,它們會附著在同一目標蛋白的兩個不同區域,所以這些分子內二價膠被稱為分子內二價膠。
這項世界領先的工作還闡明了以前未被充分認識的分子膠的特征和性質,為科學家們深入了解膠鋪平了道路,從而可以更快地發現新的類。
“我們在這里揭示的影響是不可低估的,”Ciulli教授補充說。
“這將在整個制藥行業引起連鎖反應,并有可能改變我們對藥物開發的看法。“鄧迪大學在TPD領域處于世界領先地位,我們在靶向蛋白質降解中心的新家只會進一步提高鄧迪大學在這一革命性領域的聲譽。
“我還必須向我們的合作者致敬,他們的投入對實現這一重大突破至關重要。”
來自牛津大學生命科學學院的Ciulli教授是研究TPD的領軍人物。他和他的團隊開發的降解分子現在在世界各地被用于尋找癌癥、皮膚病和神經系統疾病等疾病的新療法。近年來,TPD研究在全球范圍內吸引了數十億英鎊的投資。
參考資料
[1] Targeted protein degradation via intramolecular bivalent glues
 |
 |
 |
| 官網:www.baichuan365.com |
微信服務號:iseebio |
微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn |
微信訂閱號:seebiotech |
泉養堂:www.canmedo.com |