摘要:研究人員開展發現 SLC6A14 通過組蛋白磷酸化調控巨噬細胞炎癥,為炎癥性疾病治療提供新靶點。
在人體的免疫系統中,巨噬細胞就像一群時刻警惕的衛士,它們是免疫系統的 “先遣部隊”,一旦有外敵入侵,巨噬細胞會迅速做出反應。在正常情況下,它們能根據不同的環境需求,分泌不同的細胞因子。比如,當有病原體來襲時,炎癥性巨噬細胞會分泌白細胞介素 - 1β(IL-1β)等促炎細胞因子來清除病原體;而在組織受損時,抗炎性巨噬細胞則會分泌 IL-10 等抗炎因子來修復組織。然而,巨噬細胞的 “工作” 一旦出現差錯,就會引發各種健康問題。像是在敗血癥、感染誘導的炎癥性疾病中,巨噬細胞的表型轉換出現缺陷,炎癥性屬性持續激活,給患者帶來極大的痛苦。
同時,巨噬細胞的極化過程需要能量、物質合成等多方面的支持,這就離不開細胞的代謝重編程,而氨基酸在這個過程中扮演著重要角色。溶質載體(SLC)家族 6(SLC6)負責調節巨噬細胞對氨基酸的攝取,但是 SLC6 家族成員究竟如何影響巨噬細胞的極化和炎癥反應,在之前還是一個未解之謎。
 圖1 天冬酰胺轉運蛋白通過組蛋白磷酸化支持巨噬細胞炎癥
圖1 天冬酰胺轉運蛋白通過組蛋白磷酸化支持巨噬細胞炎癥為了揭開這個謎團,來自華南農業大學的研究人員開展了深入的研究。他們發現 SLC6A14 在炎癥性巨噬細胞中起著關鍵作用,通過一系列復雜的機制調控炎癥反應。這一研究成果發表在《SCIENCE ADVANCES》上,為炎癥性疾病的治療開辟了新的方向。
研究人員在開展研究時,用到了多種關鍵技術方法。在細胞和動物模型方面,他們分離培養了原代腹腔巨噬細胞(PEMs)、骨髓來源的巨噬細胞(BMDMs)、肺泡巨噬細胞(AMs)等,還構建了 Slc6a14fl/flLyz2Cre基因敲除小鼠模型。實驗檢測技術上,運用蛋白質免疫印跡(Western blot)檢測蛋白表達,實時熒光定量聚合酶鏈式反應(RT-qPCR)分析基因表達,酶聯免疫吸附測定(ELISA)檢測細胞因子水平,以及免疫熒光、透射電鏡等技術進行觀察分析 。
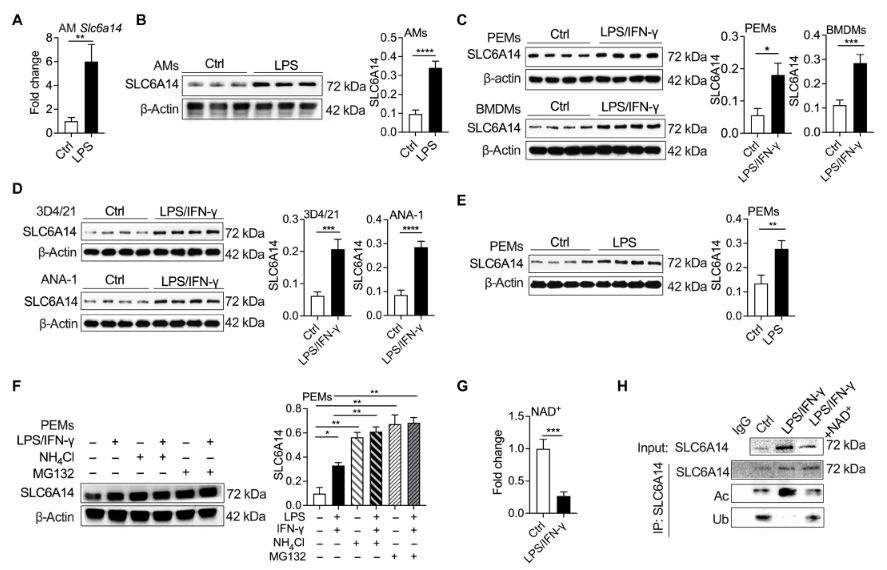 圖2 NAD+介導的乙酰化促進SLC6A14的表達
圖2 NAD+介導的乙酰化促進SLC6A14的表達下面來看具體的研究結果:
SLC6A14 與巨噬細胞介導的肺炎相關:研究人員分析轉錄組數據發現,SLC6A6 和 SLC6A14 在健康和感染肺部均高表達,且 SARS-CoV-2 等病原體感染會增加人肺中 SLC6A14 的表達。對小鼠的研究也證實,脂多糖(LPS)處理可使肺泡巨噬細胞中 SLC6A14 的 mRNA 和蛋白表達增加,表明 SLC6A14 在肺炎炎癥性巨噬細胞中高表達。
NAD+介導的乙酰化增強炎癥性巨噬細胞中 SLC6A14 的豐度:在體外實驗中,用 LPS 加干擾素 -γ(IFN-γ)刺激巨噬細胞,發現炎癥性 PEMs、BMDMs 等細胞中 SLC6A14 的蛋白表達增加。研究還發現,蛋白降解途徑影響 SLC6A14 的豐度,NAD+通過調節蛋白乙酰化和泛素化,增加炎癥性巨噬細胞中 SLC6A14 的豐度。
SLC6A14 抑制通過 NLRP3 炎性小體限制 IL-1β 分泌:使用 SLC6A14 選擇性抑制劑 α- 甲基 -(dl)- 色氨酸(α-MT)處理炎癥性巨噬細胞,發現 α-MT 可抑制 IL-1β 和腫瘤壞死因子 -α(TNF-α)的分泌。進一步研究表明,α-MT 對 NF-κB 信號通路無影響,但可阻斷 NLRP3 炎性小體的激活和組裝,還能改變線粒體相關指標,說明 SLC6A14 抑制通過 NLRP3 炎性小體限制 IL-1β 分泌。
SLC6A14 抑制通過天冬酰胺降低 NLRP3 炎性小體激活:α-MT 處理炎癥性巨噬細胞后,細胞內多種氨基酸水平下降,但 12 小時后多數氨基酸恢復,只有天冬酰胺和丙氨酸未恢復。實驗發現,補充天冬酰胺可恢復 IL-1β 分泌和 NLRP3 炎性小體激活,而補充丙氨酸則無此效果,表明 SLC6A14 抑制通過天冬酰胺降低 NLRP3 炎性小體激活。
SLC6A14 抑制通過 CCNO 抑制 MAPK 信號通路:RNA 測序分析發現,SLC6A14 抑制影響 MAPK 信號通路。免疫印跡實驗表明,SLC6A14 抑制可抑制 MAPK 信號通路的活性。進一步研究發現,Ccno 基因在 SLC6A14 介導的 IL-1β 分泌中起重要作用,沉默 Ccno 基因可激活 MAPK 信號通路和 NLRP3 炎性小體,增加 IL-1β 分泌,說明 SLC6A14 通過 CCNO-MAPK 信號調節 NLRP3 炎性小體介導的 IL-1β 分泌。
SLC6A14 抑制通過核 LKB1 促進 CCNO 轉錄:研究人員推測 SLC6A14 介導的天冬酰胺攝取通過核肝激酶 B1(LKB1)介導的組蛋白磷酸化調節 Ccno 轉錄。實驗結果顯示,SLC6A14 抑制促進 LKB1 核保留,增加組蛋白 3 pS10/28 豐度和 Ccno 翻譯,而補充天冬酰胺則會逆轉這些變化。沉默 Lkb1 基因可促進 IL-1β 分泌,支持了上述推測,即 SLC6A14 抑制通過核 LKB1 介導的組蛋白磷酸化促進 Ccno 轉錄。
SLC6A14 缺陷減少巨噬細胞中 IL-1β 分泌:研究人員構建了巨噬細胞特異性 Slc6a14 缺陷小鼠模型,發現該模型中炎癥性巨噬細胞的天冬酰胺水平降低,核 LKB1、組蛋白 3 pS10/28 和 CCNO 豐度增加,MAPK 和 NLRP3 炎性小體激活減少,IL-1β 分泌降低。補充天冬酰胺或沉默 Lkb1 基因可逆轉這些變化,進一步證實 SLC6A14 通過核 LKB1 依賴性磷酸化介導炎癥性巨噬細胞中 IL-1β 的分泌。同時,研究還確定了 SLC6A14 的 K636 乙酰化抑制其在炎癥性巨噬細胞中的泛素化。
髓系 Slc6a14 缺失減輕 LPS 誘導的肺部炎癥:在體內實驗中,LPS 刺激可增加肺部巨噬細胞中 SLC6A14 的表達,抑制 CCNO 表達。髓系 Slc6a14 缺陷的小鼠在 LPS 誘導的肺部炎癥模型中,存活率增加,肺部、血清和脾臟中的 IL-1β 產生減少,肺部炎癥減輕,炎癥性巨噬細胞比例降低,CCNO 表達增加,表明 SLC6A14 在體內調節巨噬細胞介導的肺部炎癥。
綜合研究結論和討論部分的內容,此次研究意義重大。研究揭示了 SLC6A14 介導的天冬酰胺攝取通過組蛋白磷酸化調控巨噬細胞炎癥的網絡機制,SLC6A14 有望成為治療肺炎等炎癥性疾病的關鍵靶點。不過,研究也發現 SLC6 家族成員在不同免疫疾病中功能多樣,炎癥性巨噬細胞對 SLC6 底物選擇的調節機制仍有待進一步研究。此外,LKB1 在其他細胞中的功能以及是否通過其他信號通路調節巨噬細胞功能也需要深入探索。但無論如何,這項研究為理解免疫細胞代謝與炎癥反應的關系提供了新視角,為開發治療炎癥性疾病的新策略奠定了堅實基礎。
參考資料
[1] Asparagine transporter supports macrophageinflammation via histone phosphorylation
 圖1 天冬酰胺轉運蛋白通過組蛋白磷酸化支持巨噬細胞炎癥
圖1 天冬酰胺轉運蛋白通過組蛋白磷酸化支持巨噬細胞炎癥