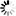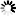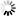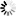摘要:圣裘德兒童研究醫院的科學家們發現了細胞存活蛋白MCL-1的代謝作用。
細胞的生與死是由一些過程控制的,如果這些過程被破壞,就會導致癌癥。細胞凋亡是細胞程序性死亡的過程,受b細胞淋巴瘤-2 (BCL-2)蛋白家族的嚴格調控。這包括骨髓細胞白血病-1 (MCL-1),一種幫助細胞存活的抗凋亡蛋白。然而,來自St. Jude兒童研究醫院的研究人員發現了MCL-1的另一個關鍵作用:調節線粒體中長鏈脂肪酸氧化的過程。這些發現發表在今天的《分子細胞》雜志上,指出了一種眾所周知的促生存蛋白的次要作用,同時為混淆的臨床試驗結果提供了見解。
蛋白質通常被想象成工具箱中的工具,每種工具都有特定的功能。但就像現代多功能工具提供了一系列的用途——根據需要切割、打磨、研磨和刮擦——蛋白質通常具有在細胞中執行多種功能的能力。BCL-2蛋白主要與維持細胞存活或判處細胞死亡的緊密結合過程有關。盡管存在這種關聯,但它們與凋亡之外的其他過程有關,其中最重要的是MCL-1。
 圖1 抗凋亡MCL-1通過與ACSL1的相互作用促進長鏈脂肪酸氧化
圖1 抗凋亡MCL-1通過與ACSL1的相互作用促進長鏈脂肪酸氧化圣猶達細胞與分子生物學系的通訊作者Joseph Opferman博士說:“對我們來說,有多少不同類型的細胞需要MCL-1來維持日常生存,這讓我們感到驚訝。”MCL-1不僅僅是細胞存活的主力;它也是一種具有未開發治療潛力的蛋白質。Opferman說:“它之所以成為治療設計的重要候選基因,是因為它是人類癌癥中最常被放大的基因之一。”
MCL-1的日常工作或許可以解釋臨床試驗中的困難
然而,在臨床試驗中,這種治療潛力不足。在臨床試驗中,無法解釋的心臟毒性導致多家制藥公司要么極其謹慎地進行,要么停止開發MCL-1抑制劑。Opferman懷疑這可能與有關線粒體內蛋白質顯示非凋亡功能的報道有關,特別是在脂肪酸代謝過程中,但這方面的證據同樣令人困惑。
“我們對MCL-1的日常工作有著長期的興趣,當它不僅僅是防止細胞死亡時,它在正常健康細胞中所做的事情,”Opferman說。“MCL-1比我們看到的要復雜得多。這種蛋白質似乎在調節線粒體生物學方面具有關鍵功能,我們想在適當的細胞中探索這一點。”
我們的新陳代謝以食物為燃料,為肌肉提供能量。然而,當我們的身體沒有得到足夠的食物時,它們會轉向脂肪儲備來彌補這一點。脂質被運送到肝臟,在那里它們被用于能量生產。研究人員在小鼠模型中追蹤了這種脂肪的命運,作為MCL-1功能的去除破壞代謝功能的一個跡象。
“很容易看到肝臟中有大量脂滴積聚,”Opferman解釋說。“我們假設這可能是利用這些脂質能力的缺陷。它們能很好地到達肝臟,但并沒有像人們想象的那樣被吃掉。”
MCL-1與脂肪酸氧化之間存在聯系
這導致研究人員,包括該研究的共同第一作者,圣裘德生物醫學科學研究生院的Tristen Wright和細胞與分子生物學系的Meghan Turnis McGehee博士,對脂質氧化是否存在缺陷進行了生化測試,最終發現肝臟氧化長鏈脂肪酸的能力存在缺陷,對短鏈脂肪酸沒有影響。長鏈脂肪酸構成了我們體內大部分脂肪酸,是重要的能量來源,也是重要的信號分子。這一發現激勵了研究人員繼續研究。
“我們渴望探索驅動這一現象的生物機制,”Opferman說。“為什么它是長鏈特異性的?”
缺失的環節以長鏈酰基輔酶a合成酶1 (ACSL1)的形式出現,ACSL1是一種指導長鏈脂肪酸氧化過程的蛋白質,并與MCL-1結合。令研究人員驚訝的是,MCL-1/ACSL1之間的結合發生在調節MCL-1抗凋亡功能的完全相同的界面上。
“我們最初制作了MCL-1的突變版本,試圖增強其與非凋亡蛋白(如ACSL1)的相互作用。當突變的MCL-1破壞與ACSL1的結合時,我們感到震驚。這一初步發現使我們能夠將相互作用映射到MCL-1的結合口袋。”
這為MCL-1抑制劑臨床試驗的缺陷提供了潛在的機制解釋:設計用于抑制MCL-1細胞存活功能的分子也阻斷了其脂肪酸氧化功能。
“我們做了很多不同的測試來讓自己相信這是真的,我仍然覺得這是我們收集到的最令人驚奇的數據之一。”
MCL-1的臨床潛力
轉向心臟,研究人員發現,去除MCL-1的功能也會破壞長鏈脂肪酸的氧化。此外,MCL-1的缺失降低了細胞的能量貨幣ATP水平。無論MCL-1被去除還是被抑制,其效果都是一致的。
這些發現為之前被低估的MCL-1功能提供了急需的見解,并證明BCL2家族蛋白可能參與細胞凋亡之外的細胞調節。雖然從治療的角度來看,MCL-1靶向的潛力尚不清楚,但研究人員樂觀地認為,進一步了解藥物機制可能會提供一條前進的道路。
“到目前為止,這些抑制劑在臨床試驗中表現不佳,但在體外,它們非常有效,”Opferman說。“我們正在研究藥物如何直接誘導細胞凋亡,而不是對脂肪酸氧化的影響。這是我們感興趣探索的事情之一。”
參考資料
[1] Anti-apoptotic MCL-1 promotes long-chain fatty acid oxidation through interaction with ACSL1