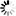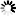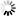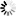更安全更快速的再生醫學策略:利用直接重編程改變細胞身份
在死亡之前,已變成皮膚細胞的細胞仍然是皮膚細胞。在過去十年,顯然細胞身份并不是一成不變的,它能夠通過激活特異性的遺傳程序而得以重寫。如今,再生醫學領域面臨著一個問題:這種重寫應當采取常規方法,即成熟細胞首先轉化回干細胞,或者如果可行的話,采取一種更加直接的方法?
術語“終末分化(terminally differentiated)”概述了一種舊的觀念---皮膚細胞、肌肉細胞或其他的成熟細胞不能夠經過誘導而獲得一種顯著不同的命運。十年前,這種觀念開始搖搖欲墜,這是因為那年日本京都大學細胞生物學家山中伸彌(Shinya Yamanaka)證實導入幾個基因能夠將成年的成纖維細胞(結締組織)轉化為誘導性多能干細胞(iPS細胞)[1]。類似于胚胎干細胞,iPS細胞能夠分化為任何一種類型的細胞,這一性質被稱作為多能性。不同于胚胎干細胞---它們必需從人胚胎中收集,因此面臨著而巨大的政治負擔---但是,iPS細胞也能夠無限量地增殖。
僅僅在山中伸彌發現誘導性多能干細胞(iPS細胞)幾年后---這一發現讓他贏取2012年諾貝爾生理學或醫學獎,研究人員就已開始發現改變細胞類型的捷徑,他們稱之為“直接重編程”,即一種類型的成熟細胞經誘導后能夠直接變成另一種類型的成熟細胞,而不需要借助產生iPS細胞這一中間階段。研究人員已了解到如何將皮膚細胞轉化為神經元或心臟細胞,如何將胃細胞轉化為分泌胰島素的β細胞。利用直接重編程產生神經元的德國美因茲古藤堡大學科學家Benedikt Berninger說,“就在你的眼前觀察這些細胞改變它們的身份是非常神奇的。”
相對于對iPS細胞的研究,對直接重編程的研究還處于更加初始的階段,但是它正激發人們對再生醫學的興趣。直接重編程的細胞可能比通過iPS細胞中間階段產生的細胞更加安全,這是因為后者可能含有多能性細胞而具有與腫瘤細胞一樣的廣泛增殖能力,這會使得它們潛在地導致癌癥產生。
基于iPS細胞的臨床介入必需謹慎地開展以便確保沒有多能性細胞與完全成熟的細胞一起移植。瑞典隆德大學神經生物學家Malin Parmar---希望利用直接重編程逆轉帕金森病患者大腦中的神經元丟失---說,“風險就是你可能失去對這些細胞的控制,它們在移植后開始不受控制地增殖。但是,如果你繞過iPS細胞產生階段,那么它更加快速和潛在地更加安全。”
改變遺傳程序
重寫細胞身份首先需要理解這些身份是如何建立的。體內的每個細胞都能追蹤它的祖先到單個起源:受精卵。當胚胎細胞分裂和成熟時,它們的命運是由發育過程中特異性的基因開啟和關閉所確定的。被稱作轉錄因子的蛋白首先結合到基因組中的某些DNA序列,隨后激活或抑制附近的基因,從而調節這一過程。控制一種發育中的細胞命運的轉錄因子經常被稱作主調節因子(master regulator),這是因為它們控制復雜的一連串基因活性。
哈佛干細胞研究所細胞生物學家Qiao Zhou說,“這些主調節因子基本上都是根據它們在胚胎發生時產生某些細胞類型中的關鍵性作用來決定的。一個祖細胞(progenitor cell)可能能夠變成細胞A、B或C,但是如果你迫使它表達某種主調節因子,它將不可避免地選擇變成細胞A。”
證實主調節因子能夠用于直接重編程的早期研究可追溯到1987年,那一年,來自弗雷德-哈金森癌癥研究中心的Harold Weintraub、Andrew Lassar和他們的同事們證實誘導成纖維細胞表達某一DNA片段能夠讓它進入變成肌肉細胞的發育途徑;他們隨后發現導致這種變化的單個基因編碼轉錄因子MyoD[2]。加州大學舊金山分校格拉斯通心血管疾病研究所心臟發育研究員Deepak Srivastava說,“這在當時是一項顛覆性的發現,也因此這個領域的人們曾認為大多數其他類型的細胞會有一種關鍵性的轉錄因子,該因子發揮如此強大的作用而足以改變細胞的命運。”
但是事情并不是這么簡單。尋找單個能夠啟動重編程的主調節因子會導致多年的沮喪,直到山中伸彌揭示出有效重編程的秘密并不是單個因子,而是多種基因的組合。隨著研究人員混合和搭配不同的主調節因子組合,成功的故事開始不斷涌現。
2008年,哈佛大學科學家Douglas Melton團隊(Zhou是該團隊的一員)將一種類型的胰腺細胞轉化為另一種產生胰島素的胰腺β細胞,其中β細胞是很多糖尿病患者所需要的。Zhou說,“我們的研究作出結論:你僅需三種主調節因子實現這一點。”2010年,斯坦福大學干細胞科學家Marius Wernig領導的一個團隊也利用三種基因將成纖維細胞轉化為神經元。對這項研究進一步優化和擴展可產生一系列不同的特化神經元,其中每種神經元產生截然不同的神經遞質信號,或者對這些不同的信號作出反應。
迄今為止,大多數開創性的直接重編程發現都是在體外培養的細胞中實現的。但是若能夠在體內促進細胞轉化的話,很多研究人員就會對再生醫學抱有更加大的希望。在一種器官中相對豐富的細胞群體可能能夠轉化為更加迫切需要的其他類型的成熟細胞。迄今為止,研究人員已在動物實驗中取得一些成就。比如,Parmar團隊發現通過將攜帶編碼重編程因子的基因的病毒載體注射進小鼠大腦中能夠將神經膠質細胞轉化為功能性的神經元。Srivastava也類似地在心臟內將小鼠成纖維細胞轉化為跳動的心肌細胞,這一策略可能提供一種治療心臟病發作導致的心臟損傷的方法。他說,“你擁有已經存在于器官中的大量細胞群體,你能夠將它們用于再生。”但是,迄今為止,還沒有人在人體內嘗試過直接重編程。
身份危機
到目前為止,大多數研究著重關注確保重編程過程成功。鑒于一種細胞類型的身份是由多種基因決定的,研究人員不僅不得不成功地找出啟動這些基因的主調節因子組合:理想上,他們也不得不發現盡可能最小的組合。這是因為迫使一種細胞表達主調節基因(master regulator gene)的最可靠方法是運送這些基因的額外拷貝到這種細胞中,而相比于運送僅僅幾種基因,運送很多種基因到細胞中是一種更加困難的技術挑戰。找出最小的主調節基因組合需要一番艱苦跋涉:通常,潛在的組合名單是比較巨大的,唯一的篩選方法就是系統性地逐一測試。比如,Parmar團隊以12種候選基因開展產生多巴胺的神經元的研究,經過一番篩選后,最終將它縮小到2種基因。
一些研究人員已開始設計專門用于直接重編程的軟件,該軟件整入關于哪些主調節因子控制組織形成的信息。一個橫跨三個大洲的團隊已開發出一種被稱作Mogrify的實驗規劃工具,這個工具將來自眾多細胞類型的大量基因表達數據與不同主調節因子控制的基因網絡方面的規則匯集在一起[4]。基于這些數據和規則,Mogrify可被用來預測將導致所需的細胞身份變化的重編程因子組合。這就為研究人員提供一種方法在計算上鑒定出盡可能最少的主調節基因組合,這一組合能夠將一種特定類型的細胞直接重編程為另一種特定類型的細胞。
但是提供有活性的主調節基因并不足以確保完全的重編程:這些主調節基因可能成功地將細胞設置在一個發育途徑上,但是會讓它處于一種未成熟的前體細胞狀態。因此接下來的任務就是鑒定出其他的哪些基因必須處于活性狀態來完成這一發育過程。
中國北京大學干細胞生物學家鄧宏魁(Hongkui Deng)教授多年來努力解決這個問題。他剛開始努力通過只誘導主調節基因表達將皮膚細胞直接轉化為肝細胞。在第二輪篩選時,他又鑒定出能夠完成這種重編程的其他基因[5]。他將它們稱為成熟因子(maturation factor),即在啟動轉化時并不發揮重要作用但在獲得功能性的成熟細胞中起著至關重要作用的基因。
其他研究人員已發現他們能夠利用在促進重編程的細胞信號通路中發揮作用的化學物擴大主調節基因的效應,從而提高直接重編程的成功效率,有時化學物獨自也能夠促進細胞類型轉換。
即便使用合適的基因和化學衍生物也難以證實一種直接重編程是否是真正完成的。利用顯微鏡進行觀察能夠揭示出一種轉化是否發生---比如,扁平的星形的成纖維細胞是否形成長長的軸突狀突出,但是也需要對細胞的內部運作進行更加深入的分析。簡而言之,一個人如何確保皮膚細胞經重編程后是否真正地變成神經元,而不只是神經元類似物?
檢測主調控基因的下游活性能夠對細胞重編程如何好地成功完成提供深入認識。如果導入的主調控基因確實發揮作用的話,它們應當導致細胞核中的全局基因表達模式發生重大的變化,那么哪種變化應當匹配在靶組織的成熟細胞中發現的表達模式呢?有幾種方法研究細胞的全局基因表達,比如,對細胞中的所有RNA分子進行測序。來自波士頓大學和哈佛大學的研究人員已利用這種類型的測序數據開發一種能夠評估重編程細胞中的基因活性如何好地匹配靶基因中的基因活性的軟件程序CellNet[6]。
然而,真正重要的細胞身份測試是重編程細胞是否在功能上能夠替換自然分化的細胞。德州大學西南醫學中心神經生物學家Chun-Li Zhang說,“如果它們看起來像是神經元,而且它們的基因表達也類似于神經元,那么這并不意味著它們是真正的神經元。”令人信服的證據需要接受一系列評估,比如利用電生理學測量證實一種新形成的神經元是否放電,因而是否能夠激活與它通過突觸連接在一起的其他神經元。Zhou說,沒有一種特征性的評估方法能夠獨自地提供足夠說服力的證據。他的團隊將肝細胞重編程為胰腺β細胞的努力只產生功能異常的中間物。他說,“它們合成和釋放大量的胰島素---如此之多以至于動物死于低血糖癥。”這是因為它們缺乏胰腺細胞檢測血糖水平并對它作出反應的能力。
這些測試的一大發現是在靶器官內促進細胞重編程通常要比在體外培養的細胞中表現得更好。Srivastava說,“當在塑料材料上時,我們細胞中的大多數經過重編程后只是部分地變成心肌細胞。但是在它們的天然環境中,它們中的絕大多數進入跳動的狀態,并且與它們的周圍細胞在電學上偶聯在一起。”這可能是因為器官中的其他周圍細胞產生的化學信號,或者是因為在三維組織環境中的特征很難在實驗室中再現。無論出于何種原因,它很好地預示著臨床應用開發。
通往臨床應用之路
研究人員同意在這些方法能夠在人體內測試之前,還有很多障礙要克服。一般而言,已證實相比于小鼠細胞,人細胞在進行直接重編程時更加充滿挑戰:它們傾向于花費更長時間經歷這個重編程過程,而且雖然一些轉錄因子足以在動物實驗中實現直接重編程,但是人細胞經常需要額外的轉錄因子。
基因轉運也帶來巨大的挑戰,特別是將基因轉運進大腦等器官中。在一些情形下,偏好感染特定細胞類型的病毒能夠有助引導重編程因子進入特定的患病或損傷位點,但是運送到不需要的位點可能仍然會帶來風險。
不過,還會存在拆了東墻補西墻的問題。在大腦中,將神經膠質細胞轉化為神經元會降低那里的神經膠質細胞數量,而這本身可能就產生風險。Berninger說,“這些細胞不是裝飾門面。它們也發揮重要的功能,但是如果我們把它們拿走了,我們該如何替換它們呢?”一種可能性就是細胞在經重編程后進入一種增殖性的---但非致瘤性的---神經祖細胞(neural progenitor)狀態。那樣的話,一些神經膠質細胞可能能夠產生大量的神經元。

綠色的是“天然”的心肌細胞,而橙色的則是由纖維細胞直接重編程為心肌細胞
心臟治療很可能最接近于臨床應用。Srivastava團隊已開始研究將豬心臟內的成纖維細胞轉化為心肌細胞。他說,“我們有初步的概念驗證:即便在像我們這樣的大的心臟中,我們也能夠實現轉化的效果。”如今,這個團隊正在開展安全性研究,而且正在優化他們的基因運送方法,以便實現獲得監管部門批準用于人體臨床試驗的目標。重要的是,心臟成纖維細胞能夠自我補充,因此對細胞丟失的擔憂并不那么嚴重。
Zhou團隊努力將體外培養的人胃腸道細胞直接轉化為β細胞,并且也正在努力在診所中開展應用。這些腸道細胞很容易通過活組織檢查獲得,而且在體外培養和重編程后,在理論上,它們能夠移植到患有糖尿病的志愿者的胰腺中。
直接重編程正開始獲得產業界的關注,不過生物技術公司和制藥公司并沒有準備好全心全意地投入其中。盡管從某種意義上說,對iPS細胞和胚胎干細胞的研究有先發優勢,但是隨著細胞類型直接轉化的優勢日益突出,這一差距可能會被填平。Zhou說,“迄今為止,還沒有同等數量的資源和人力投入到這種方法中。但是這個領域正在快速趕上,我迫不及待地想看到它將會如何發展。”
新聞鏈接
 |
 |
 |
| 官網:www.baichuan365.com | 微信服務號:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信訂閱號:seebiotech | 泉養堂:www.canmedo.com |
此文關鍵字:iPS細胞|直接重編程
相關資訊
- 蛋白質修飾研究現狀與未來
- 中國藥品定價歷史上最大規模的改革塵埃落定
- 優異的化妝品級水溶性β-1,3-葡聚糖
- 癌癥疫苗的研究
- 細胞培養常見問題及其解決
- 檢測免疫球蛋白ELISA試劑盒
- 【盤點】新發現的癌癥標志物
- Aging Cell:關鍵酶可預防細胞衰老
- 供應疏水聚合物 - 聚苯乙烯系列1
- Science重磅:發現15個引發頭頸部鱗狀細胞癌快速生長的基因
新進產品
同類文章排行
- 清除人體內衣原體感染的關鍵鑰匙
- iScience:一種對抗遺傳性神經系統疾病的潛在途徑
- 真的有可以中和所有已知COVID-19毒株的抗體?
- 細胞“廢物”使抗癌的免疫細胞恢復活力!
- 男性注意!這種食品攝入過多會導致結直腸癌
- 無路可退!主食中的農藥殘留,可誘發阿爾茨海默病
- Cell出乎意料新發現:原來是這種“瀕死體驗”讓癌細胞惡化
- 研究發現,冠狀病毒的形狀會影響其傳播
- Science Advances新突破:快速高效生產人體免疫細胞的新方法
- 《Nature Genetics》確定10個克羅恩病相關基因
資訊文章
您的瀏覽歷史