細菌也成帶路黨!ACS NANO: 多功能菌基納米酶實現腫瘤治療精準打擊
化學動力療法(CDT)是一種通過腫瘤微環境(TME)內源性活性氧(ROS)破壞腫瘤細胞的治療方法。然而,由于腫瘤自身的抗氧化能力以及靶向性等問題限制了CDT的進一步發展。略是提高CDT療效的一種很有前途的方法,可以極大地降低其對腫瘤靶向的依賴,并大大降低副作用。
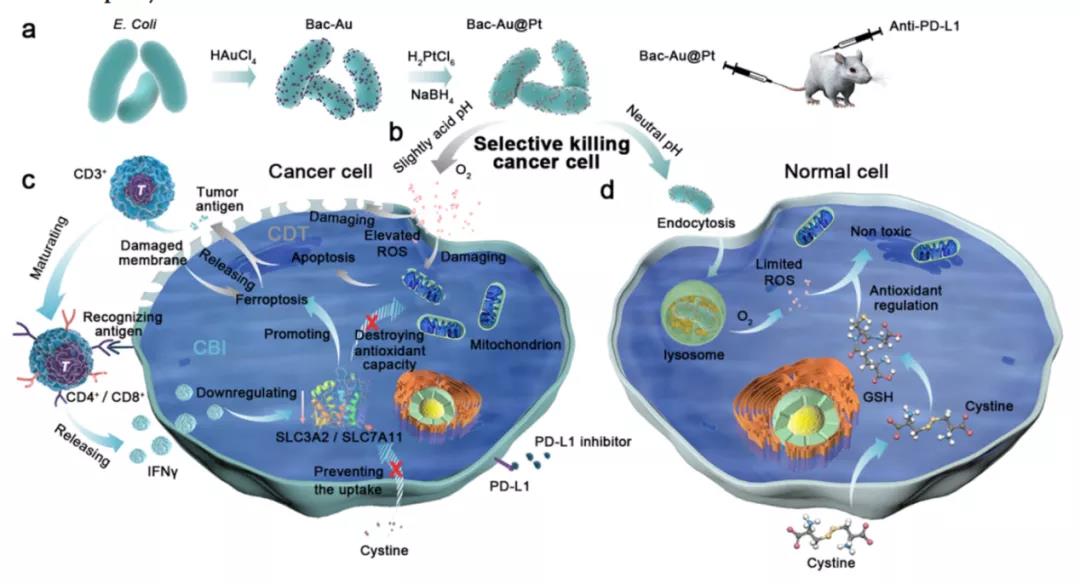
2021年12月,來自南洋理工大學和華中農業大學的研究團隊在《ACS NANO》發表了題為“Precise Chemodynamic Therapy of Cancer by TrifunctionalBacterium-Based Nanozymes”的文章,報道了金和鉑金屬復合物(Au@Pt)修飾到細菌表面(Bac-Au@Pt)得到的新型多功能<納米酶系統,此納米酶系統可以作為一種反應溫和、副作用小的新型藥物對癌癥進行精準化學動力學治療。
由于細菌對腫瘤的靶向能力和Au@Pt納米酶在酸性條件下的催化特性,該納米系統可以有效地向腫瘤細胞釋放ROS。此外,該納米酶系統還可以刺激T細胞釋放干擾素γ,特異性地降低腫瘤細胞內的抗氧化性。這種納米系統使化學動力學治療(CDT)和免疫治療互相協同,低劑量的Bac-Au@Pt在免疫治療的協同作用下也能實現高抗癌效果,是一個非常有潛力的治療方案。

本研究中,研究者們在大腸桿菌表面合成了Au@Pt核殼結構,構成了納米酶系統(稱為Bac-Au@Pt),用于B16-F10黑素瘤小鼠模型的細菌誘導免疫治療和精準化學動力學治療。納米系統給藥后,Au@Pt納米酶在微酸性的腫瘤微環境中產生ROS,然后啟動腫瘤細胞的凋亡程序,釋放腫瘤抗原并將其呈遞給T細胞。在這一過程中,成熟的T細胞釋放干擾素γ到腫瘤細胞并阻止胱氨酸的攝取,破壞腫瘤細胞的抗氧化能力,增加了ROS對腫瘤細胞的毒性,從而達到了高度精確的治療效果。
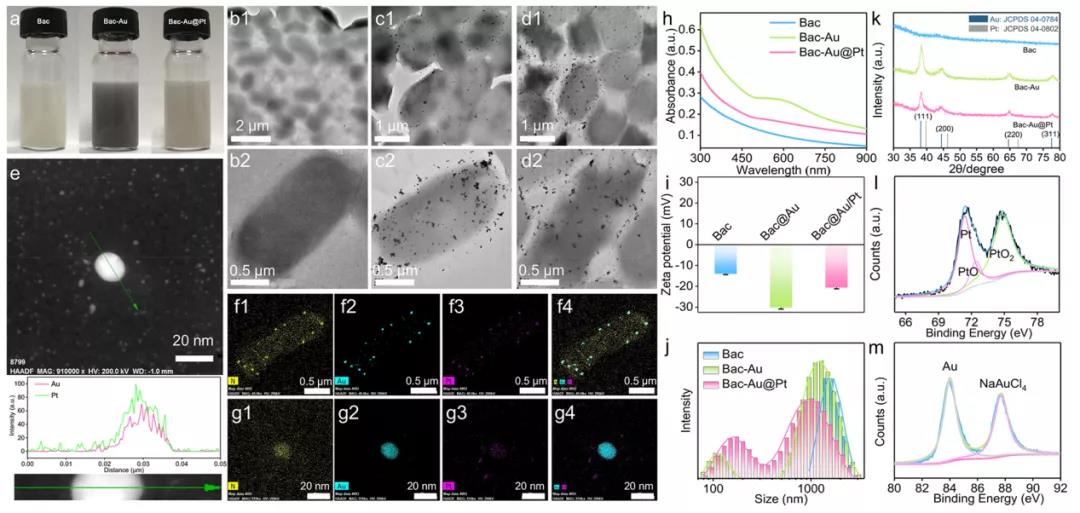
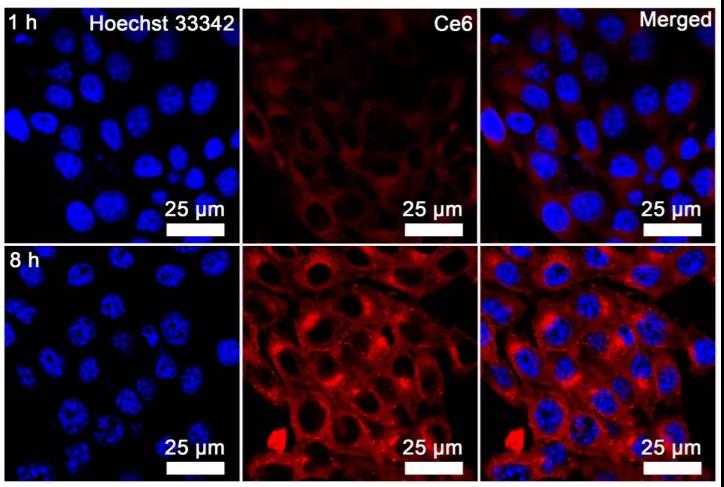
首先,研究者們使用大腸桿菌(e.c oli)在厭氧條件還原氯金酸,在其表面生成了Au納米顆粒。在此過程中加入H2PtCl6、檸檬酸鈉和NaBH4,Au納米粒子表面覆蓋了一層很薄的Pt。通過高角環形暗場掃描透射電子顯微鏡對Pt層的存在進行了表征,Pt元素的分布與Au元素的分布重疊,證明了Pt層在Au納米顆粒上的原位生長。此外,研究者們還分別用紫外吸收光譜、DLS、XRD、XPS等手段對細菌(Bac)、細菌+金(Bac-Au)和細菌+Au@Pt(Bac-Au@Pt)材料進行了表征,充分證明了多功能菌基納米酶系統的成功合成。在成功制備Bac-Au@Pt后,研究者們通過共聚焦激光掃描顯微鏡(CLSM)研究Bac-Au@Pt的細胞攝取,結果顯示Bac-Au@Pt在8小時內被細胞內吞。
隨后,研究者們用Bac-Au@Pt在酸性溶液中加入3,3,5,5 -四甲基聯苯胺(TMB)檢測ROS的產生。在不加入H2O2的情況下,從紫外可見光譜中可以看出,282 nm處的峰隨著孵育時間的延長而減少,370和652 nm處的峰隨著孵育時間的延長而增加。這說明了TMB的快速氧化,表明Bac-Au@Pt產生了催化ROS。然后,比較pH為6.4和7.4時產生的ROS數量,并記錄652 nm處的吸收值,以表示TMB的氧化程度。結果表明,當pH為6.4時,Bac-Au@Pt能快速氧化TMB,產生的ROS量比pH為7.4時增加6倍。
為了明確Bac-Au@Pt產生的ROS種類,研究人員記錄了Bac-Au@Pt在磷酸緩沖液(pH6.4和7.4)中的電子自旋共振(ESR)譜。如圖2c、d所示,檢測到超氧自由基和單線態氧升高。由于上述試驗中沒有添加H2O2,所以ROS的產生應歸因于Bac-Au@Pt的溶解氧催化轉化。
由于腫瘤組織微環境為微酸性,酸性溶液環境中具有較高ROS生成率更適合于腫瘤化學動力學治療。研究者們在體外研究了Bac-Au@Pt的CDT效率。實驗表明,>在中性條件下,Bac-Au@Pt對4種細胞株處理24或48小時后的所有細胞的存活率也接近100%,顯示出良好的的體外生物相容性。Bac-Au@Pt的細胞毒理學實驗表明:Bac-Au@Pt在pH為6.4時能有效產生ROS,引起細胞膜脂質過氧化損傷,是殺死癌細胞的關鍵因素。而在pH 7.4時,BacAu@Pt的脂質過氧化損傷是有限的,因此在中性pH (pH 7.4)時,Bac-Au@Pt不會對正常組織造成損傷。此外, pH 6.4環境中,細胞的線粒體被BacAu@Pt產生的ROS破壞,而在正常生理環境中,線粒體保持完整。
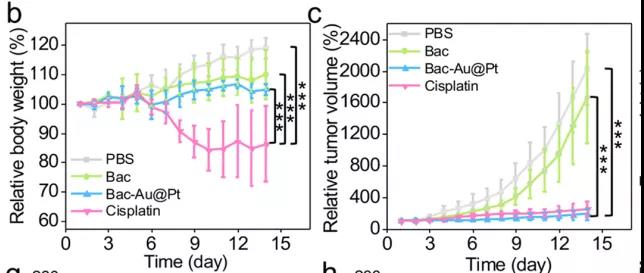
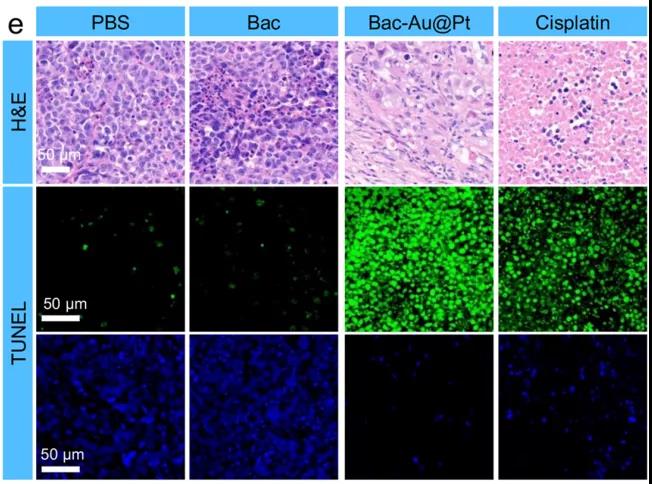
研究者們還進行了Bac-Au@Pt體內化學動力療法的實驗。首先,研究者們選擇了缺乏正常的免疫系統的Babl/C裸鼠,排除了任何潛在免疫作用。研究者們對這些小鼠模型進行了14天的治療,數據表明:對照組(PBS組和Bac組)腫瘤生長迅速,而治療組腫瘤抑制成功。PBS、Bac、Bac-Au@Pt組小鼠在治療期間體重在正常范圍內波動,而順鉑組(cisplatin)小鼠體重持續下降,Bac-Au@Pt組小鼠的腫瘤體積和重量明顯小于PBS組和Bac組。因此,順鉑雖然具有與Bac-Au@Pt相似的抗腫瘤作用,但對小鼠有明顯的副作用,造成小鼠體重明顯下降。不僅如此,收集小鼠組織進行組織病理學分析發現,根據腫瘤組織蘇木精和伊紅(H&E)染色,治療組細胞核數量明顯減少,說明Bac-Au@Pt和順鉑治療效果顯著。通過末端脫氧核苷酸轉移酶介導的熒光素標記(TUNEL)實驗顯示,藍色熒光減少,綠色熒光顯著增加,表明腫瘤細胞凋亡處于晚期。
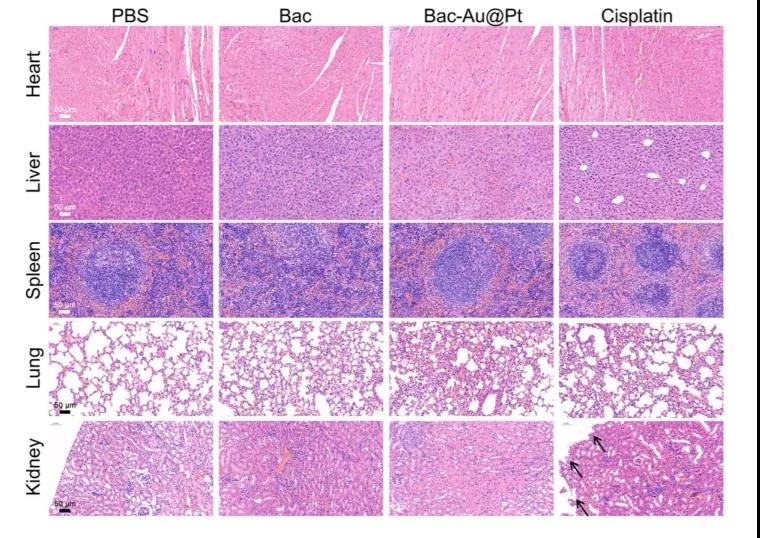
研究者們為驗證Bac-Au@Pt的生物安全性,測定了其在器官中的Au元素含量。結果顯示,金元素在心臟(0.89%ID/g)、肝臟(2.11%ID/g)、脾臟(1.68%ID/g)、肺(1.13%ID/g)和腎臟(1.86%ID/g)中殘留很低。這些結果表明,大多數Au@ Pt納米顆粒從體內被消除。研究者們還觀察Bac-Au@Pt對小鼠肝腎功能的影響。血清中谷丙轉氨酶(ALT)、天冬氨酸轉氨酶(AST)、白蛋白/球蛋白(A/G)水平與肝功能相關,尿酸(UA)、尿素氮(BUN)水平與腎功能相關。盡管Bac-Au@Pt在肝臟和腎臟有較高的積累,Bac和Bac- au@ Pt治療組的ALT、AST、A /G、UA和BUN水平與PBS組相似。這些結果表明Bac-Au@Pt在治療期間沒有可檢測到的肝和腎損傷。而順鉑組AST和A/G值分別顯著升高和降低,提示順鉑會導致肝功能損害。雖然順鉑和Bac-Au@Pt在腫瘤治療中療效相似,但Bac-Au@Pt的副作用遠小于順鉑。
此外,研究者們還發現細胞內谷胱甘肽(GSH)是由細胞產生以應對氧化應激。因此,無論是正常細胞還是腫瘤細胞,都具有一定的天然抗氧化能力。T細胞會向腫瘤細胞釋放IFNγ,從而阻斷GSH的主要來源胱氨酸的攝取,降低腫瘤細胞的抗氧化能力。
總之,本研究開發了一種基于細菌的Au@Pt核殼納米酶,通過化學動力學和免疫治療相結合來解決進行腫瘤的精準化學動力學治療。Bac-Au@Pt在血液循環過程中積累在腫瘤部位,在酸性條件下將溶解的氧氣催化成超氧自由基和單線態氧。在此過程中,由于T細胞釋放IFNγ,腫瘤細胞中GSH的含量大幅度降低,而正常細胞中GSH的含量保持不變。因此,ROS只破壞腫瘤細胞而不破壞正常細胞,顯著提高了治療效果,減少了副作用。因此,基于細菌的納米酶平臺的聯合治療策略是提高CDT療效的一種很有前途的方法,可以極大地降低其對腫瘤靶向的依賴,并大大降低副作用。
 |
 |
 |
| 官網:www.baichuan365.com | 微信服務號:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信訂閱號:seebiotech | 泉養堂:www.canmedo.com |
此文關鍵字:腫瘤細胞
相關資訊
- 好消息!上海西寶生物修飾性PEG “買一送一”
- 研究揭示重要形態發生素BMP的分泌調控機制
- 2018年2月西寶員工生日會
- 納他霉素Natamycin(CAS:7681-93-8)-西寶生物專業提供
- 提供PEG共聚物或嵌段共聚物系列產品技術轉讓或技術合成服務
- 糖尿病研究ELISA試劑盒 - - 疾病診斷及研究系列(2)
- 研究發現細胞再生肝組織無腫瘤發生
- 人類機體DNA中古老的病毒“入侵者”或幫助機體抵御感染
- 德國德樂 NBB-增菌培養液(NBB-B-AM)
- 利用酮類物質治療阿爾茨海默病
新進產品
同類文章排行
- 清除人體內衣原體感染的關鍵鑰匙
- iScience:一種對抗遺傳性神經系統疾病的潛在途徑
- 真的有可以中和所有已知COVID-19毒株的抗體?
- 細胞“廢物”使抗癌的免疫細胞恢復活力!
- 男性注意!這種食品攝入過多會導致結直腸癌
- 無路可退!主食中的農藥殘留,可誘發阿爾茨海默病
- Cell出乎意料新發現:原來是這種“瀕死體驗”讓癌細胞惡化
- 研究發現,冠狀病毒的形狀會影響其傳播
- Science Advances新突破:快速高效生產人體免疫細胞的新方法
- 《Nature Genetics》確定10個克羅恩病相關基因
資訊文章
您的瀏覽歷史