乙型肝炎病毒(HBV),簡稱乙肝病毒,是一種DNA病毒,屬于嗜肝DNA病毒科(Hepadnavividae),可導致肝硬化和肝癌的發生,給全球帶來嚴重的疾病負擔。據世界衛生組織(WHO)報道,全球有20多億人曾受到過乙型肝炎病毒(HBV)感染,大約3.5億至4億人罹患慢性乙肝病毒(HBV)感染,在亞洲和非洲發病率尤其高。我國的乙肝病毒感染率約60%-70%;乙肝表面抗原攜帶率約占總人口的7.18%,以此計算,全國約有9300萬人攜帶乙肝病毒,其中慢性乙型肝炎患者約2000萬例。
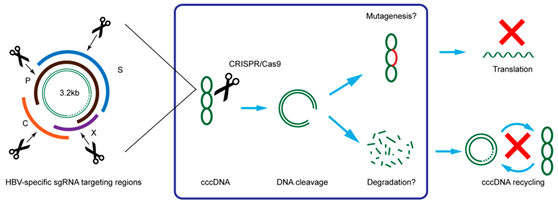
盡管現有的抗病毒藥物可以控制乙型肝炎病毒,但卻不能完全清除它。因此,一旦停止治療患者肝臟中的HBV會重新活化。這是因為cccDNA “匿藏”在細胞核中。
細胞外的乙型肝炎病毒DNA是一種松弛環狀的雙鏈DNA(relaxed circularDNA,rcDNA)分子。HBV的基因組(rcDNA)進入到細胞核后,rcDNA在病毒蛋白和宿主細胞因子的幫助下修復成共價閉合環狀DNA(cccDNA)。cccDNA是乙肝病毒前基因組RNA復制的原始模板。
只要還存在于肝細胞中,乙肝病毒cccDNA的復制就不會停止,并與病毒蛋白裝配成新的完整HBV病毒顆粒,以芽生的方式再感染健康的肝細胞,而這是導致 乙肝復發的根本原因。因此,盡管每個肝細胞內只有約5~50個cccDNA拷貝,但是只要這些cccDNA池穩定,就可以使得病毒的持續感染延續,因而清 除肝細胞內的cccDNA是乙肝徹底治愈所必需的。
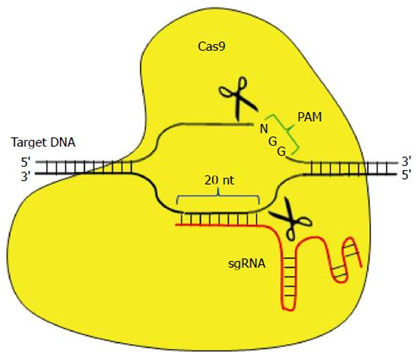
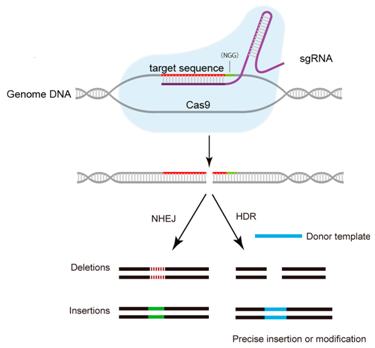
CRISPR/Cas9系統靶向結合特異性的DNA序列,誘導靶DNA雙鏈發生精確切割。在哺乳動物細胞中,這樣的切割能夠被一種被稱作非同源末端連接(non-homologous end-joining, NHEJ)的緊急修復系統快速地修復。NHEJ是高效的,但是并不很準確,因而經常導致一些DNA堿基在修復位點上插入或剔除。鑒于每次讀取DNA時是按密碼子(每個密碼子由連續的三個堿基組成)讀取的,在關鍵位點上發生的這些小的DNA序列變化經常破壞相應的基因和它的蛋白產物的功能。基于,世界各地的研究人員嘗試利用CRISPR/Cas9系統治療HBV感染,并且取得重大進展。
1. Sci Rep:利用CRISPR/Cas9系統高效地抑制HBV
Scientific Reports, 02 June 2015, doi:10.1038/srep10833
在一項新研究中,麻省理工學院的研究人員利用CRISPR/Cas9 系統,對受到HBV感染的哺乳動物肝細胞進行基因組編輯,從中刪除了乙肝病毒(HBV)DNA。他們靶向切割了HBV病毒共價閉合環狀DNA(cccDNA)中的一些特異性位點。
在這項研究中,Vyas Ramanan和同事們設計了24條單向導RNA(sgRNA)來靶向從在線病毒序列信息資源庫中鑒別出的一些HBV基因組位點。經過初篩測試后,研究小組將三種最有效的sgRNA和Cas9蛋白插入到慢病毒載體中,然后將它們轉導進將HBV DNA整合到宿主基因組的人類肝細胞內。
通過利用包含整合性HBV基因組DNA的穩定轉染細胞系展開實驗,研究人員觀察到HBV總DNA和cccDNA逐漸減少,在36天時cccDNA下降了92%。他們還觀察到HBV病毒基因表達和復制水平顯著減少。
如今,Ramanan計劃在人類肝臟嵌合小鼠模型中測試這一方法,以評估和優化傳遞方法和給藥方法,及更好地了解需要除去多少的cccDNA才能到達人類功能性的治愈。
2. Mol Ther Nucleic Acids:利用CRISPR/Cas9抑制HBV感染
Molecular Therapy Nucleic Acids, 2014 December; 3(12): e216, doi:10.1038/mtna.2014.68
在一項新的研究中,為了研究源自傳染性HBV的cccDNA是否能夠被直接靶向摧毀,來自美國福克斯蔡斯癌癥中心(Fox Chase Cancer Cente)的研究人員在表達HBV受體---鈉離子-牛磺膽酸共轉運蛋白(sodium taurocholate cotransporting polypeptide, NTCP)---的人HepG2中使用CRISPR/Cas9基因編輯系統。他們測試了不同的HIV特異性的向導RNA(gRNA),并證實它們能夠高達8倍地抑制HBV感染。這種抑制是HBV cccDNA發生突變和缺失---類似于Cas9切割染色體DNA和隨后基于NHEJ介導的DNA修復時觀察到的情形---所導致的。α干擾素(IFN-α)并不對CRISPR/Cas9系統的抗病毒活性產生可衡量的影響,這提示著Cas9和NHEJ活性并不受這種細胞因子(即IFN-α)誘導的先天免疫反應的影響。
3. Mol Ther:利用CRISPR/Cas9讓HBV cccDNA功能性滅活
Molecular Therapy, online publication 21 June 2016; doi: 10.1038/mt.2016.94
在一項新的研究中,通過采用下一代測序(NGS)技術,來自美國福克斯蔡斯癌癥中心(Fox Chase Cancer Cente)的Christoph Seeger、Ji A Sohn和同事們確定了在Cas9切割和基于非同源末端連接(NHEJ)的修復后,HBV cccDNA所發生的完整突變譜。他們發現,90%以上的乙肝病毒DNA都能被Cas9切割。此外,研究結果還表明,在Cas9切割后對HBV DNA進行基因編輯的效率是在對被HBV感染的細胞進行α干擾素(IFN-α)處理后發生的APOBEC蛋白介導的胞嘧啶脫氨基作用的1500倍以上。研究還發現,以前用來檢測DNA胞嘧啶脫氨基作用的3D-PCR方法方法高估了發生基因編輯的HBV DNA的數量和頻率。
總之,研究人員證實CRISPR/Cas9系統是迄今為止在功能上讓HBV cccDNA失活和提供一種慢性乙肝治愈療法的最好途徑。
4. Gene Ther:我國科學家利用CRISPR破壞乙肝病毒
Gene Therapy, 2015, 22, 404–412; doi:10.1038/gt.2015.2; published online 5 February 2015
2015年2月5日,來自我國軍事醫學科學院放射與輻射醫學院研究所、第四軍醫大學西京醫院、日本京都大學和華中農業大學獸醫學院等處的研究人員,在Nature旗下Gene Therapy期刊上發表一項最新的研究成果,題為“Harnessing the clustered regularly interspaced short palindromic repeat (CRISPR)/CRISPR-associated Cas9 system to disrupt the hepatitis B virus”。
在這項研究中,研究人員研究靶向乙肝表面抗原(HBsAg)編碼區的CRISPR/Cas9系統,在體外培養的肝細胞中和活的小鼠體內的效果。結果表明,CRISPR/Cas9可在體內和體外抑制HBV復制和表達,可能是治療HBV感染的一種新策略。
5. Mol Ther Nucleic Acids:利用CRISPR/Cas9系統在體內促進肝內HBV模板清除
Molecular Therapy Nucleic Acids, 2014, 3, e186; doi:10.1038/mtna.2014.38
在當前的抗病毒治療下,HBV cccDNA持續存在是根治慢性乙肝的一大障礙。治愈慢性乙肝需要新的策略來特異性地破壞HBV cccDNA。為了研究CRISPR/Cas9系統是否能夠切割HBV基因組,來自中國國立臺灣大學的研究人員設計出8種針對A基因型HBV的gRNA。
利用這些HBV特異性的gRNA,CRISPR/Cas9系統顯著性地降低感染上HBV表達載體的Huh7細胞中的乙肝核心抗原(HBcAg)和乙肝表面抗原(HBsAg)產生。在這8種篩選出的gRNA中,他們鑒定出兩種有效的gRNA。有趣的是,其中的一種靶向保守性HBV序列的gRNA在不同基因型的HBV中都能發揮作用。
利用一種流體動力學-HBV持續存在小鼠模型,研究人員進一步證實這種CRISPR/Cas9系統能夠切割肝內含有HBV基因組的質粒,促進它在體內被清除,從而導致血液中的HBsAg水平下降。
這些數據提示著CRISPR/Cas9系統能夠在體外和體內破壞HBV表達模板,并且表明它有潛力根除持續性HBV感染。
6. Virus Res:利用CRISPR/Cas9系統在體內和體外誘導抗HBV效應
Virus Research, Volume 217, 2 June 2016, Pages 125–132, doi:10.1016/j.virusres.2016.04.003
在一項新的研究中,來自中國同濟大學生命科學與技術學院的研究人員利用CRISPR/Cas9系統靶向剔除HBV基因組中的保守性區域。通過讓核酸內切酶Cas9攜帶HBV S基因和X基因的同源序列,他們構建出pCas9。通過利用pCas9開展實驗,他們證實pCas9-2能夠更好抵抗HBV產生,而且在Huh7和HepG2細胞之間沒有顯著差異。
在M-TgHBV的HBV感染小鼠模型中,注射pCas9會降低血液中的HBsAg水平和肝臟中的HBcAg水平。
總之,這種人工構建的CRISPR/Cas9系統能夠誘導抗HBV效應,而且有潛力作為一種新的療法治療慢性HBV感染。
7. Sci Rep:利用CRISPR/Cas9系統破壞HBV S基因和X基因保守性序列
Scientific Reports, 2015 Sep 3;5:13734. doi: 10.1038/srep13734
為了在治療上應用于人體,人工設計出的核酸內切酶Cas9應當能夠識別不同基因型的HBV,同時產生最小的脫靶效應。
針對此,在一項新的研究中,德國研究人員鑒定出HBV基因組的S區域和X區域在不同基因型中都保守的HBV序列,而且能夠利用一種Cas9酶特異性地和高 效地靶向切割這些保守性序列。這一方法不僅破壞報告細胞系中的游離HBV cccDNA和HBV在染色體上的整合靶位點,而且也破壞慢性感染和新感染的肝癌細胞系中的HBV復制。
這些數據提示著將CRISPR/Cas9系統作為旨在治愈HBV感染的新策略具有可行性。
8. World J Gastroenterol:利用雙gRNA指導的CRISPR/Cas9系統高效地抑制HBV復制
World Journal of Gastroenterology, 2015 Aug 28; 21(32):9554-65, doi:10.3748/wjg.v21.i32.9554
為了篩選和研究有效地抵抗A、B、C和D基因型HBV的gRNA,來自中國北京大學醫學部的研究人員總共設計出15種gRNA(分別記為gRNA-1,gRNA-2,…,gRNA-15)。他們從中選擇了11種靶向HBV基因組調節區域的雙gRNA組合。他們研究了每種gRNA和這11種雙RNA組合抑制A、B、C和D基因型HBV復制的效率。
研究人員證實所有的gRNA能夠顯著地抑制體外細胞培養物中的HBsAg或HBeAg產生,所有雙RNA組合能夠高效地抑制A、B、C和D基因型HBV中的HBsAg或HBeAg產生,而且當與單個gRNA相比時,雙RNA組合抑制HBsAg或HBeAg產生的效率顯著增加。
再者,通過利用PCR直接測序,研究人員證實這些雙gRNA組合能夠通過移除這兩種使用的gRNA的切割位點之間的序列片段,特異性地破壞HBV表達模板。最為重要的是,gRNA-5和gRNA-12的雙gRNA組合不僅能夠高效地抑制HBsAg和/或HBeAg產生,而且也破壞HepAD38細胞中的HBV cccDNA池。
這些結果提示著CRISPR/Cas9系統能夠高效地破壞HBV表達模板(A、B、C和D基因型HBV),而且沒有明顯的細胞毒性。
9. J Gen Virol:利用CRISPR/Cas9系統抑制不同基因型HBV復制
Journal of General Virology, 2015 Aug;96(8):2252-61, doi:10.1099/vir.0.000159
為了研究利用CRISPR/Cas9系統是否可能破壞HBV DNA模板,來自中國武漢大學的研究人員設計出8種靶向不同基因型HBV的保守區域的gRNA,而且這些gRNA能夠在體外和體內顯著地抑制HBV復制。
再者,這種HBV特異性的gRNA/Cas9系統能夠抑制不同基因型HBV在細胞中的復制,而且利用單個gRNA/Cas9系統能夠顯著降低HBV DNA,而且利用不同的gRNA/Cas9系統組合能夠清除HBV DNA。
10. Antiviral Res:利用CRISPR/Cas9系統高效抑制HBV復制
Antiviral Research, Volume 118, June 2015, Pages 110–117, doi:10.1016/j.antiviral.2015.03.015
作為一種新的基因組編輯工具,CRISPR/ Cas9系統能夠被用來準確地和高效地改造和修飾基因組DNA。
在一項新的研究中,來自中國蘇州大學的研究人員合成出4種靶向HBV基因組保守區域的單向導RNA(sgRNA)。在Huh7細胞和HBV復制性細胞HepG2.2.15中,CRISPR/Cas9系統降低HBV產生。他們進一步證實CRISPR/Cas9的直接切割和這種切割介導的突變發生于轉染細胞的HBV cccDNA中。
在攜帶HBV cccDNA的小鼠模型中,通過快速地尾靜脈注射含sgRNA-Cas9的質粒導致較低水平的HBV cccDNA和HBV蛋白產生。
總之,這種CRISPR/Cas9系統能夠準確地和高效地靶向HBV cccDNA和抑制HBV復制。它有可能被用來治療慢性HBV感染。
11. Virology:利用CRISPR/Cas9系統抑制HBV DNA積累
Virology, Volume 476, February 2015, Pages 196–205, doi:10.1016/j.virol.2014.12.001
在一項新的研究中,來自美國杜克大學和埃默里大學的研究人員通過對細菌Cas9基因和單向導RNA(sgRNA)進行慢病毒轉導,觀察到在體外的HBV慢性感染和新感染的模型中,HBV DNA產生受到高效抑制。HBV特異性的Cas9/sgRNA組合降低總HBV DNA水平高達1000倍左右和降低HBV cccDNA水平高達10倍左右,而且也通過突變讓殘留的絕大多數HBV DNA失活。
總之,這些數據提供概念驗證表明CRISPR/Cas9系統有潛力有效地剔除慢性HBV感染者體內的HBV cccDNA池。