摘要:研究人員開發了一種新的高效基因組編輯工具,稱為多路正交堿基編輯器(MOBEs)
人類基因組由大約30億個堿基對組成,人類的基因組成有99.6%是相同的。這微不足道的0.4%解釋了人與人之間的差異。這些堿基對的特定突變組合為復雜健康問題的病因提供了重要線索,包括心臟病和精神分裂癥等神經退行性疾病。
目前在活細胞中建模或校正突變的方法效率很低,特別是在多路復用時——在基因組中同時安裝多個點突變。加州大學圣地亞哥分校的研究人員開發了一種新的高效基因組編輯工具,稱為多路正交堿基編輯器(MOBEs),可以一次安裝多個點突變。他們的研究由化學和生物化學助理教授Alexis Komor的實驗室領導,發表在《自然生物技術》雜志上。
 圖1 多路正交堿基編輯器(MOBE)系統的開發
圖1 多路正交堿基編輯器(MOBE)系統的開發Komor的團隊對比較DNA中單個字母變化的基因組特別感興趣。這些字母——C(胞嘧啶),T(胸腺嘧啶),G(鳥嘌呤),A(腺苷)——被稱為堿基。一個人的堿基是C,另一個人的可能是T。這些是單核苷酸變異(snv)或單點突變,一個人可能有4-5百萬個變異。有些變種是無害的;有些是有害的;通常是多種變異的組合導致疾病。
在疾病建模中使用基因組的一個問題是可能的變異數量之多。如果科學家們試圖確定哪些基因突變導致了心臟病,他們可以解碼一群患有心臟病的人的基因組,但任何兩個人之間的變異數量使得很難確定哪種變異組合導致了疾病。
“解釋基因變異是一個問題。事實上,大多數被發現的變異在臨床上都沒有分類,所以我們甚至不知道它們是致病的還是良性的,我們的目標是通過在受控的實驗室環境中安裝多種變體來制造一種可用于疾病建模的工具,從而可以進一步研究它們。”文章一作Quinn T. Cowan說。
基因編輯的進化
為了理解mobe被創造出來的原因,我們必須了解傳統基因編輯工具CRISPR-Cas9的局限性。CRISPR-Cas9使用一種向導RNA,它的作用就像GPS信號一樣,直接到達你想要編輯的基因組位置。Cas9是一種DNA結合酶,它可以切斷DNA的兩條鏈,使其完全斷裂。
雖然相對簡單,但雙鏈斷裂對細胞是有毒的。這種類型的基因編輯也可能導致缺失——隨機插入和刪除——細胞無法完美地修復自身。在CRISPR-Cas9中編輯多個基因會增加風險。
Komor的實驗室使用她開發的堿基編輯技術來代替CRISPR,這種技術可以對DNA進行化學改變,盡管一次只能進行一種類型的編輯(例如,從C到T或從a到G)。因此,堿基編輯不是一次剪掉整個部分,而是一次擦除和替換一個字母。它速度較慢,但效率更高,對細胞的危害也更小。
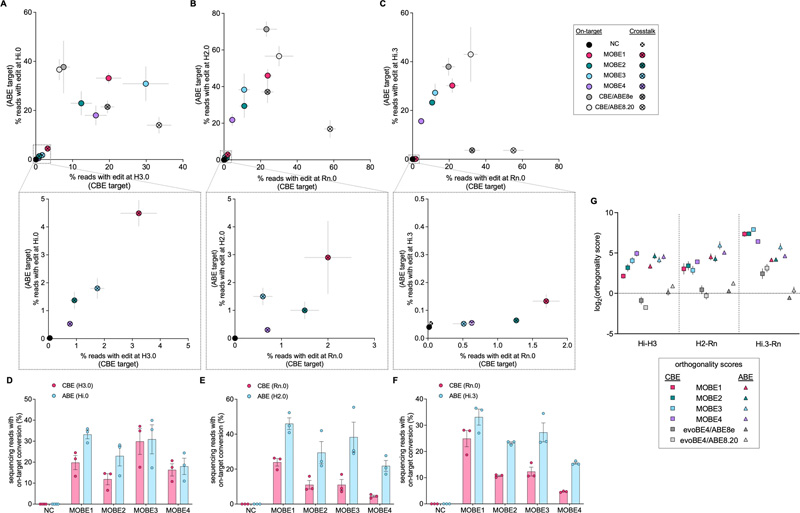 圖2 當靶向不同染色體上的兩個原間隔體時,MOBEs和親本BEs的靶上和串擾編輯效率
圖2 當靶向不同染色體上的兩個原間隔體時,MOBEs和親本BEs的靶上和串擾編輯效率同時應用兩個或更多堿基編輯器(將基因組中一個位置的C變為T,將另一個位置的a變為G),可以更好地建模多基因疾病-由于多個遺傳變異而發生的疾病。然而,沒有一種技術可以在沒有引導RNA“串擾”的情況下有效地做到這一點,當堿基編輯器做出不必要的改變時,就會發生這種情況。
Cowan的mobe使用一種被稱為適體的RNA結構——與特定蛋白質結合的小RNA環——將堿基修飾酶招募到特定的基因組位置,從而高效地同時編輯多個位點,并降低串擾的發生率。
該系統新穎,是首次利用適體以正交模式招募腺苷堿基編輯器(ABEs)與胞嘧啶堿基編輯器(CBEs)合成mobe。
區別是明顯的:當CBE和ABE一起給出而不使用MOBE時,串擾發生率高達30%。使用MOBE時,串擾小于5%,同時實現30%的轉換效率所需的基極變化。
該研究是測試MOBE系統可行性的原理驗證,已獲得臨時專利。為了進一步驗證這些理論,研究小組進行了幾個真實疾病的案例研究,包括一種罕見的激素紊亂——卡爾曼綜合征。他們的實驗表明,MOBE系統可以有效地編輯某些多基因疾病的相關細胞系。
“我們正在把質粒放到AddGene上,這樣任何人都可以自由訪問它們。我們希望其他研究人員將使用mobe來模擬遺傳疾病,了解它們是如何表現的,然后有希望創造有效的治療方法。”
參考資料
[1] Development of multiplexed orthogonal base editor (MOBE) systems
 |
 |
 |
| 官網:www.baichuan365.com |
微信服務號:iseebio |
微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn |
微信訂閱號:seebiotech |
泉養堂:www.canmedo.com |