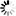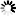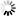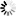摘要: 一項新的研究發(fā)現(xiàn),“隨機DNA”在單細胞真菌酵母中自然活躍。
一項新的研究發(fā)現(xiàn),“隨機DNA”在單細胞真菌酵母中自然活躍,而在哺乳動物細胞中,這種DNA在其自然狀態(tài)下被關閉,盡管它們在10億年前有共同的祖先,并且具有相同的基本分子機制。
這項新發(fā)現(xiàn)圍繞著DNA遺傳指令首先轉化為一種名為RNA的相關物質(zhì),然后轉化為構成身體結構和信號的蛋白質(zhì)的過程展開。在酵母、小鼠和人類中,基因表達的第一步,轉錄,是DNA分子“字母”(核堿基)在一個方向上被讀取時進行的。雖然80%的人類基因組——我們細胞中的全套DNA,被積極地解碼成RNA,但實際上只有不到2%的基因編碼指導蛋白質(zhì)的構建。
基因組學中一個長期存在的謎團是,所有這些非基因相關的轉錄是如何完成的。它只是噪音,是進化的副作用,還是有它的功能?
紐約大學朗格尼健康中心(NYU Langone Health)的一個研究小組試圖通過創(chuàng)造一個巨大的合成基因來回答這個問題,該基因的DNA編碼與自然母體的順序相反。然后,他們將合成基因放入酵母和小鼠干細胞中,觀察它們的轉錄水平。
這項新研究發(fā)表在3月6日的《自然》雜志上,揭示了酵母的遺傳系統(tǒng)是這樣設置的,幾乎所有的基因都在持續(xù)轉錄,而在哺乳動物細胞中,同樣的“默認狀態(tài)”是轉錄被關閉。
這項發(fā)表在《自然通訊》雜志上的研究不僅揭示了IncREST是應激反應的關鍵組成部分,而且還可能是對抗各種癌癥的有效治療靶點。
 圖1 反向合成序列揭示默認的基因組狀態(tài)
圖1 反向合成序列揭示默認的基因組狀態(tài)有趣的是,該研究的作者說,代碼的反向順序意味著酵母和哺乳動物細胞中進化的所有開啟或關閉轉錄的機制都不存在,因為反向代碼是無意義的。然而,就像鏡像一樣,反向密碼反映了自然密碼中的一些基本模式,包括DNA字母出現(xiàn)的頻率、它們靠近的位置以及它們重復的頻率。由于反向代碼有10萬個分子字母長,研究小組發(fā)現(xiàn)它隨機包含了許多以前未知的代碼的小片段,這些代碼可能更頻繁地開始轉錄,并在哺乳動物細胞中停止轉錄。
“了解不同物種之間的默認轉錄差異將有助于我們更好地了解遺傳密碼的哪些部分具有功能,哪些是進化的意外,這反過來又有望指導酵母的工程,制造新藥,或創(chuàng)造新的基因療法,甚至幫助我們找到隱藏在龐大密碼中的新基因。”通訊作者 Jef Boeke博士說。
這項研究也為以下理論提供了依據(jù):酵母非常活躍的轉錄狀態(tài)是固定的,因此外來DNA很可能被轉錄成RNA。外來DNA很少被注入酵母,比如病毒在復制自身時注入酵母。如果RNA構建了一種具有有益功能的蛋白質(zhì),那么這種編碼將作為一種新基因被進化保存下來。與酵母中的單細胞生物不同,哺乳動物細胞作為由數(shù)百萬個協(xié)同細胞組成的身體的一部分,每當細胞遇到病毒時,它們就不那么自由地吸收新的DNA。酵母中的單細胞生物可以提供有風險的新基因,從而加速進化。許多監(jiān)管機制保護微妙平衡的代碼。
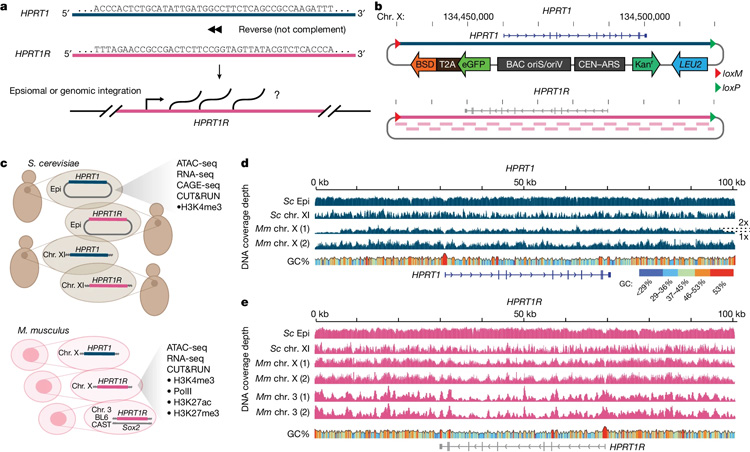 圖2 合成HPRT1和HPRT1R的設計和構建
圖2 合成HPRT1和HPRT1R的設計和構建大DNA
這項新研究必須考慮到DNA鏈的大小,人類基因組中包含30億個“字母”,有些基因長達200萬個字母。雖然著名的技術可以一個字母一個字母地進行改變,但如果研究人員從零開始構建DNA,將大量預先組裝的代碼交換到一個細胞中,以取代自然對應的細胞,對一些工程任務進行廣泛的改變,效率會更高。
由于人類基因非常復雜,Boeke的實驗室首先在酵母中開發(fā)了“genome writing”方法,將其應用于哺乳動物的遺傳密碼。該研究的作者使用酵母細胞在一個步驟中組裝長DNA序列,然后將它們放入小鼠胚胎干細胞中。
在最新研究中,研究小組通過以反向編碼順序引入合成的101千堿基工程DNA -人類基因次黃嘌呤磷酸核糖基轉移酶1 (HPRT1),解決了轉錄在進化過程中如何普遍存在的問題。他們觀察到該基因在酵母中的廣泛活性,盡管缺乏啟動子的無意義代碼,即進化為轉錄開始信號的DNA片段。
此外,研究小組還發(fā)現(xiàn)了反向編碼中的小序列,腺苷和胸腺嘧啶構建塊的重復延伸,已知可被轉錄因子識別,轉錄因子是與DNA結合以啟動轉錄的蛋白質(zhì)。作者說,只有5到15個堿基長,這樣的序列很容易隨機出現(xiàn),可能部分解釋了酵母非常活躍的默認狀態(tài)。
相反,將相同的反向編碼插入小鼠胚胎干細胞的基因組中,并沒有引起廣泛的轉錄。在這種情況下,即使進化的CpG二核苷酸(已知主動關閉(沉默)基因)在反向編碼中不起作用,轉錄也受到抑制。研究小組推測,哺乳動物基因組中的其他基本元素可能比酵母更嚴格地限制轉錄,可能是通過直接招募一種已知的沉默基因的蛋白質(zhì)組(多梳復合體)來實現(xiàn)的。
第一作者Brendan Camellato是Boeke實驗室的研究生,他說:“我們越接近將‘基因組價值’的無意義DNA引入活細胞,就越能更好地將其與實際的進化基因組進行比較。這可能會引領我們進入工程細胞療法的新前沿,因為植入更長的合成dna的能力使我們能夠更好地了解基因組能夠耐受的插入物,也許還能包含一個或多個更大、完整的工程基因。”
參考資料
[1] Synthetic reversed sequences reveal default genomic states