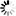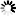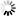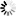新型冠狀病毒SARS-CoV-2屬于β冠狀病毒屬,是一種包膜病毒,含有較大的由核衣殼蛋白(N)包裹的正義RNA基因組。三個(gè)跨膜蛋白被整入病毒脂質(zhì)包膜:刺突蛋白(S)和兩個(gè)較小的蛋白,即膜蛋白(M)和包膜蛋白(E)。當(dāng)通過低溫電鏡(cryo-EM)成像時(shí),β冠狀病毒呈近似球形顆粒,直徑在100納米上下浮動,內(nèi)含致密的病毒質(zhì)(viroplasm),由突脂質(zhì)雙層包圍著,S蛋白三聚體(下稱S三聚體)從脂質(zhì)雙層中突出。SARS-CoV-2的S三聚體結(jié)合到靶細(xì)胞表面上的受體ACE2,并介導(dǎo)隨后的病毒攝取和融合。在這樣做的過程中,S蛋白經(jīng)歷了顯著的結(jié)構(gòu)重排,從融合前的構(gòu)象切換到融合后的構(gòu)象。S蛋白融合前和融合后的整體結(jié)構(gòu)在冠狀病毒中是非常保守的。
在感染過程中,冠狀病毒廣泛地重塑細(xì)胞的內(nèi)部膜結(jié)構(gòu),產(chǎn)生病毒復(fù)制細(xì)胞器以便在其中進(jìn)行病毒復(fù)制。S蛋白,連同蛋白M和E,被插入到內(nèi)質(zhì)網(wǎng)(ER)的膜中,并被運(yùn)送到內(nèi)質(zhì)網(wǎng)-高爾基體中間區(qū)室(ER Golgi intermediate compartment, ERGIC)。封裝的基因組出芽到ERGIC中以形成病毒顆粒,隨后將病毒顆粒運(yùn)送到質(zhì)膜并釋放出去。S蛋白是通過先在S1/S2位點(diǎn)隨后在S2'位點(diǎn)進(jìn)行蛋白酶切割,從而為膜融合做好準(zhǔn)備。
包括SARS-CoV-2在內(nèi)的冠狀病毒的S蛋白融合前結(jié)構(gòu)已通過可溶性的分泌形式的S蛋白異位表達(dá),隨后進(jìn)行純化和cryo-EM成像,得到了廣泛研究。在S蛋白融合前結(jié)構(gòu)中,受體結(jié)合結(jié)構(gòu)域(RBD)位于融合核心(fusion core)上方的一個(gè)較寬的S三聚體刺突結(jié)構(gòu)的頂部。在含有三個(gè)RBD的S三聚體中,每個(gè)RBD被一個(gè)顯示出一定流動性的N端結(jié)構(gòu)域(NTD)包圍著。在封閉的融合前結(jié)構(gòu)中,所有三個(gè)RBD平鋪在刺突結(jié)構(gòu)表面上,在很大程度上封閉了受體結(jié)合位點(diǎn),而在開放的融合前結(jié)構(gòu)中,一個(gè)或多個(gè)RBD向上抬起,從而暴露受體結(jié)合位點(diǎn)。S三聚體的表面發(fā)生廣泛的糖基化,每個(gè)S蛋白單體有22個(gè)潛在的N-糖基化位點(diǎn)。在結(jié)合受體ACE2后,從融合前到融合后的結(jié)構(gòu)轉(zhuǎn)變讓S蛋白的融合肽和跨膜結(jié)構(gòu)域聚集在一個(gè)以三螺旋束為中心的長針狀結(jié)構(gòu)的一端。五個(gè)N連接的聚糖沿融合后的S三聚體刺突結(jié)構(gòu)的長度間隔分布。
充分理解S蛋白如何發(fā)揮作用,以及它們?nèi)绾闻c免疫系統(tǒng)相互作用,需要了解病毒顆粒內(nèi)S三聚體的結(jié)構(gòu)、構(gòu)象和分布。在一項(xiàng)新的研究中,來自英國醫(yī)學(xué)研究理事會分子生物學(xué)實(shí)驗(yàn)室和德國海德堡大學(xué)的研究人員利用cryo-EM方法研究了S三聚體在病毒顆粒表面上的結(jié)構(gòu)、構(gòu)象和分布。相關(guān)研究結(jié)果于2020年8月17日在線發(fā)表在Nature期刊上,論文標(biāo)題為“Structures and distributions of SARS-CoV-2 spike proteins on intact virions”。
 圖1.SARS-CoV-2病毒產(chǎn)生特征和圖片,
圖1.SARS-CoV-2病毒產(chǎn)生特征和圖片,
圖片來自Nature, 2020, doi:10.1038/s41586-020-2665-2。為了避免與病毒濃縮或純化相關(guān)的偽影(artefacts),這些作者想要在不濃縮或純化病毒的情形下對來自感染細(xì)胞的上清液的SARS-CoV-2病毒進(jìn)行成像。利用SARS-CoV-2(病毒分離株Germany/BavPat1/2020)感染VeroE6細(xì)胞。在感染48小時(shí)后,上清液經(jīng)澄清后用甲醛固定滅活,并在-80℃下儲存。蛋白印跡法(Western blot)顯示,病毒顆粒上大約45%的S蛋白單體在多精氨酸切割位點(diǎn)上切割成S1和S2(圖1a)。固定的上清液通過驟凍玻璃化,并通過cryo-EM成像。固定可能有助于通過交聯(lián)讓一些蛋白構(gòu)象穩(wěn)定化,但預(yù)計(jì)不會產(chǎn)生任何新的構(gòu)象。正如預(yù)期的那樣,考慮到細(xì)胞上清液中病毒的濃度(約107個(gè)噬菌斑形成單位/ml, PFU/ml),他們發(fā)現(xiàn)少量的病毒顆粒分散在網(wǎng)格周圍---這些病毒顆粒通過低溫電子斷層掃描(cryo-electron tomography, cryo-ET)成像(圖1b)。
SARS-CoV-2病毒顆粒是近似球形的,到脂質(zhì)雙層外邊緣的直徑為91±11納米(n = 179)。它們含有與N蛋白相對應(yīng)的顆粒狀密度,并綴有S三聚體(圖1b,c)。這些特征與利用cryo-EM成像的其他冠狀病毒的特征基本一致。從這種病毒表面上突出的S三聚體有兩種形態(tài)--少數(shù)是延長的薄結(jié)構(gòu),這讓人聯(lián)想到融合后的構(gòu)象,而大多數(shù)是更寬的結(jié)構(gòu),這讓人聯(lián)想到融合前的構(gòu)象。這一觀察結(jié)果與近期在預(yù)印本服務(wù)器上發(fā)表的一份論文(bioRxiv, 2020, doi:10.1101/2020.03.02.972927)---該論文顯示了用核酸修飾劑β-丙內(nèi)酯滅活的純化SARS-CoV-2病毒的cryo-EM圖像,在該圖像中僅在病毒表面上觀察到薄薄的突起---形成了鮮明的對比,但與原位觀察到的病毒組裝相一致。
這些作者還收集了SARS-CoV-2感染CALU-3細(xì)胞后產(chǎn)生的病毒顆粒的斷層掃描圖,其中Calu-3細(xì)胞是一種人肺癌細(xì)胞系,在病毒感染上產(chǎn)生的病毒滴度與VeroE6細(xì)胞相當(dāng)。CALU-3細(xì)胞產(chǎn)生的這些病毒顆粒的形態(tài)和S三聚體在病毒顆粒表面上的外觀與從VeroE6細(xì)胞產(chǎn)生的病毒顆粒所觀察到的相一致。蛋白印跡分析表明,約73%的S蛋白為裂解形式。
SARS-CoV-2病毒顆粒含有24±9個(gè)S三聚體。這個(gè)值低于之前假設(shè)S蛋白等距離分布的估計(jì)值,這是因?yàn)镾蛋白在病毒表面分布不均勻。一小群病毒顆粒僅含有很少的S三聚體,而較大的病毒顆粒則含有更多的S三聚體。這些作者從179個(gè)病毒顆粒中鑒定出4104個(gè)寬的S三聚體和116個(gè)薄的S三聚體,并對它們進(jìn)行子斷層掃描圖平均化(subtomogram averaging)。平均化的結(jié)構(gòu),在7.7和22埃的分辨率下,分別非常好地對應(yīng)于之前公布的純化S三聚體在融合前和融合后形式下的結(jié)構(gòu)(圖2a)。總體而言,約97%的S三聚體是融合前形式,3%是融合后形式。融合前和融合后的S三聚體形式似乎是均勻地分布在病毒顆粒中。
 圖2.針對完整病毒顆粒上的SARS-CoV-2 S三聚體的結(jié)構(gòu)分析,
圖2.針對完整病毒顆粒上的SARS-CoV-2 S三聚體的結(jié)構(gòu)分析,
圖片來自Nature, 2020, doi:10.1038/s41586-020-2665-2。這些作者還收集了SARS-CoV-2感染CALU-3細(xì)胞后產(chǎn)生的病毒顆粒的斷層掃描圖,其中Calu-3細(xì)胞是一種人肺癌細(xì)胞系,在病毒感染上產(chǎn)生的病毒滴度與VeroE6細(xì)胞相當(dāng)。CALU-3細(xì)胞產(chǎn)生的這些病毒顆粒的形態(tài)和S三聚體在病毒顆粒表面上的外觀與從VeroE6細(xì)胞產(chǎn)生的病毒顆粒所觀察到的相一致。蛋白印跡分析表明,約73%的S蛋白為裂解形式。病毒表面上的融合前S三聚體可能主要處于封閉構(gòu)象,它的開放構(gòu)象可通過ACE2結(jié)合誘導(dǎo)或穩(wěn)定化,或者它在融合前也可能存在開放構(gòu)象。當(dāng)用作免疫原時(shí),開放或封閉的構(gòu)象可誘導(dǎo)不同范圍的抗體,目前人們正在努力產(chǎn)生穩(wěn)定在其中一種構(gòu)象的S蛋白構(gòu)造體。
為了評估S三聚體是否存在于開放和/或封閉的構(gòu)象,這些作者對S三聚體中的S蛋白單體的RBD區(qū)域進(jìn)行分類。他們發(fā)現(xiàn)三種類型:RBD處于封閉位置的S蛋白;RBD處于開放位置的S蛋白;RBD以封閉位置為主但密度有所減弱的S蛋白,這表明存在更多的可移動構(gòu)象。
考慮到每個(gè)S蛋白單體被分配到的類型,這些作者推導(dǎo)出完全封閉的S三聚體結(jié)構(gòu),以及其中一個(gè)RBD是開放的S三聚體結(jié)構(gòu),這兩者分別代表了3854個(gè)融合前S三聚體中的約31%和約55%(圖2b)。他們還發(fā)現(xiàn)了少量S三聚體(3854個(gè)融合前S三聚體中的約14%)的兩個(gè)RBD處于開放構(gòu)象(圖2b)。這些觀察結(jié)果證實(shí)在重組S三聚體中觀察到的RBD的開放也發(fā)生在病毒表面上,并且穩(wěn)定在封閉和開放構(gòu)象中的人工S蛋白構(gòu)造體都代表了原位存在的結(jié)構(gòu)。因此,這種受體結(jié)合位點(diǎn)在原位隨機(jī)暴露,并可與ACE2以及與抗體相互作用。
這些S三聚體并不都是直接從病毒表面突出來的。它們可以向膜傾斜90°,盡管傾斜超過50°就不那么有利。這些作者根據(jù)S三聚體相對于膜的方向?qū)λ鼈冞M(jìn)行分組,并且分別對每組進(jìn)行平均化。這些平均化的結(jié)構(gòu)表明膜近端莖區(qū)域作為一個(gè)鉸鏈有足夠的靈活性,允許向各個(gè)方向傾斜(圖2c)。
這些作者構(gòu)建出SARS-CoV-2病毒顆粒的模型,在該模型中,S三聚體的位置、方向和構(gòu)象是通過子斷層掃描圖平均化確定的(圖2d)。S三聚體似乎是隨機(jī)分布在病毒表面上,它們的位置、方向和構(gòu)象之間沒有明顯的聚類或關(guān)系。在SARS-CoV-2中,每1000 平方納米膜表面大約有一個(gè)S三聚體,相比之下,在甲型流感病毒中,每100平方納米膜表面大約有一個(gè)S三聚體。在SARS-CoV-2中,S蛋白的稀疏分布以及它們主要處于封閉狀態(tài)意味著與大流行性流感病毒相比,受體結(jié)合可能較少依賴于親和效應(yīng)。這與S蛋白和ACE2之間的親和力(在nM范圍內(nèi))比血凝素和唾液酸之間的親和力(mM范圍)高相一致。
上清液中低濃度的病毒顆粒使得解析出高分辨率的結(jié)構(gòu)變得困難。因此,這些作者通過蔗糖墊層離心沉淀法對這些病毒顆粒進(jìn)行濃縮。濃縮的病毒顆粒偏離球形形態(tài),但是它們的整體特征仍保留下來。他們對這些病毒顆粒進(jìn)行了cryo-ET成像和子斷層掃描圖平均化,觀察到的主要是融合前S三聚體,偶爾有融合后S三聚體。在對融合前S蛋白進(jìn)行分類后,他們只能識別出處于封閉位置的RBD,以及觀察到RBD密度較弱的S蛋白單體。
從感染細(xì)胞的上清液中的病毒顆粒主要顯示融合前S三聚體,這些S三聚體處于封閉或開放的融合前構(gòu)象。通過蔗糖墊層離心法濃縮的病毒顆粒繼續(xù)呈現(xiàn)融合前構(gòu)象,但不再觀察到開放構(gòu)象。其他研究已表明,用β-丙內(nèi)酯,而不是甲醛滅活的病毒顆粒主要處于融合后狀態(tài)。從膜中純化的S三聚體僅處于封閉的融合前構(gòu)象和融合后構(gòu)象,而其他研究已提示著可溶性S三聚體中的開放RBD是在一系列連續(xù)不同的位置中發(fā)現(xiàn)的。這些觀察表明這些作者在濃縮之前而不是濃縮之后觀察到的S蛋白的開放融合前構(gòu)象是脆弱的(盡管文中進(jìn)行了固定),并可能受到純化過程的影響。
這些作者的數(shù)據(jù)提示著滅活和純化方法可以改變?nèi)诤锨昂腿诤虾笮问降谋壤约伴_放和封閉形式的比例。據(jù)推測,病毒表面上大量的融合后S蛋白可能通過屏蔽融合前形式保護(hù)這種病毒,或者可能將宿主反應(yīng)轉(zhuǎn)向非中和抗體。鑒于在完整的病毒顆粒上觀察到小一部分融合后S三聚體刺突結(jié)構(gòu),這些作者認(rèn)為這不太可能是病毒在感染過程中的重要防御機(jī)制,但它可能是疫苗接種的一個(gè)重要考慮因素。基于滅活病毒顆粒的候選疫苗正在開發(fā)中。根據(jù)不同的制備方式,這些疫苗可能會向免疫系統(tǒng)呈現(xiàn)不同的S蛋白表位,因此它們誘導(dǎo)中和反應(yīng)的能力也不同。比如,β-丙內(nèi)酯經(jīng)常用于疫苗生產(chǎn)(如用于流感病毒亞單位疫苗),但如果融合后S三聚體誘導(dǎo)非中和反應(yīng),那么β-丙內(nèi)酯可能不是SARS-CoV-2病毒S蛋白疫苗配方制備期間用于病毒滅活的最佳選擇。
接下來,這些作者利用cryo-EM對濃縮的SARS-CoV-2病毒進(jìn)行二維成像,并對那些從病毒顆粒側(cè)面突出的融合前S三聚體進(jìn)行單顆粒分析,從而產(chǎn)生3.4埃分辨率的融合前S三聚體共識結(jié)構(gòu)。對RBD單體進(jìn)行集中分類和部分信號減法,可將它們分為兩類。與通過cryo-ET發(fā)現(xiàn)樣品中不存在開放構(gòu)象相一致的是,這些作者觀察到81%的S蛋白單體中RBD處于封閉構(gòu)象,19%的S蛋白單體中RBD的密度較弱,但主要處于封閉位置。他們將所有三個(gè)RBD都處于封閉構(gòu)象的S三聚體(53%的數(shù)據(jù))以及至少一個(gè)RBD的密度減弱的S三聚體(47%的數(shù)據(jù))的結(jié)構(gòu)分別優(yōu)化到3.5埃和4.1埃的分辨率(圖3a)。這兩種結(jié)構(gòu)高度相似,僅在一個(gè)RBD的密度水平上有所不同。他們利用這種具有三個(gè)封閉RBD的結(jié)構(gòu),建立并完善了S三聚體在病毒表面原位的原子模型。
 圖3.利用單顆粒重建方法確定SARS-CoV-2 S三聚體在完整病毒顆粒上的結(jié)構(gòu)
圖3.利用單顆粒重建方法確定SARS-CoV-2 S三聚體在完整病毒顆粒上的結(jié)構(gòu)
圖片來自Nature, 2020, doi:10.1038/s41586-020-2665-2。在這些作者建立的結(jié)構(gòu)中,S蛋白表面上的聚糖位置得到了很好的解決:在22個(gè)預(yù)測的N-糖基化位點(diǎn)中,有17個(gè)存在密度(圖3b)。其他5個(gè)糖基化位點(diǎn)位于無序的NTD環(huán)或莖區(qū)域,并沒有在高分辨率下解決。在S三聚體的底部,一個(gè)清晰的聚糖環(huán)在莖區(qū)域上形成一個(gè)項(xiàng)圈。相比于已公布的可溶性胞外結(jié)構(gòu)域結(jié)構(gòu),莖區(qū)域的密度延伸了2個(gè)螺旋轉(zhuǎn)彎(helical turn)并在更低的分辨率下進(jìn)一步延長,直到由于莖區(qū)域的靈活性而逐漸消失(圖3c)。SARS-CoV-2的S三聚體分布稀疏,可以高度向膜傾斜。這意味著,在頭部區(qū)域基部和莖區(qū)域的抗原表位將被抗體接觸到,在那里它們得不到聚糖殼的廣泛保護(hù)。
這些作者比較了S三聚體的原位結(jié)構(gòu)和以前使用外源表達(dá)的純化蛋白獲得的結(jié)構(gòu)。最近的一項(xiàng)針對溶于去污劑膠團(tuán)的全長S三聚體的研究確定了在可溶性S蛋白胞外結(jié)構(gòu)域三聚體的大多數(shù)結(jié)構(gòu)中沒有觀察到的兩個(gè)特征:S蛋白的氨基酸殘基14-26存在明確的密度;S蛋白的氨基酸殘基833和853之間形成折疊環(huán)(folded loop)。這個(gè)環(huán)是在S蛋白胞外結(jié)構(gòu)域的封閉構(gòu)象結(jié)構(gòu)中折疊形成的,并可能在內(nèi)體(endosome)的低pH條件下折疊。這些作者僅在氨基酸殘基14-26觀察到較弱的密度,但是他們沒有觀察到833-853區(qū)域形成折疊結(jié)構(gòu)。這些作者進(jìn)行過成像的SARS-CoV-2毒株含有廣泛傳播的D614G替換突變,這種突變破壞了這個(gè)氨基酸殘基與K854之間形成的鹽橋(圖3d),并可能減少833-854折疊環(huán)的折疊。他們沒有觀察到對應(yīng)于結(jié)合型脂質(zhì)或其他結(jié)合型輔助因子的額外密度。S三聚體可能以罕見的構(gòu)象存在著,但這不是它們在原位時(shí)的一般特征。
總的來說,這些作者確定的結(jié)構(gòu)非常類似于通過雙脯氨酸突變進(jìn)行穩(wěn)定化的可溶性三聚體胞外結(jié)構(gòu)域在封閉融合前形式下的結(jié)構(gòu)。這對正在使用的重組純化S三聚體用于研究、診斷和疫苗接種提供了重要的驗(yàn)證,畢竟它們確實(shí)代表了S三聚體的原位結(jié)構(gòu)。通過展示S三聚體在病毒表面上在3.4埃分辨率下的結(jié)構(gòu)(圖3),這些數(shù)據(jù)讓這些作者樂觀地認(rèn)為,cryo-EM可以用于研究抗體結(jié)合病毒顆粒表面上的S三聚體。這樣的研究可能提供中和抗體如何阻斷病毒感染的新見解,特別是靶向S蛋白的膜近端區(qū)域的抗體,從而可以為用于疫苗接種的免疫原設(shè)計(jì)提供信息。
參考資料:
Zunlong Ke et al. Structures and distributions of SARS-CoV-2 spike proteins on intact virions. Nature, 2020, doi:10.1038/s41586-020-2665-2.