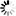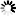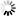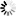Nature子刊:炎性體保護干細胞免于癌變
 圖1 基質炎性小體Ras對Myc驅動的淋巴結生成的保護作用
圖1 基質炎性小體Ras對Myc驅動的淋巴結生成的保護作用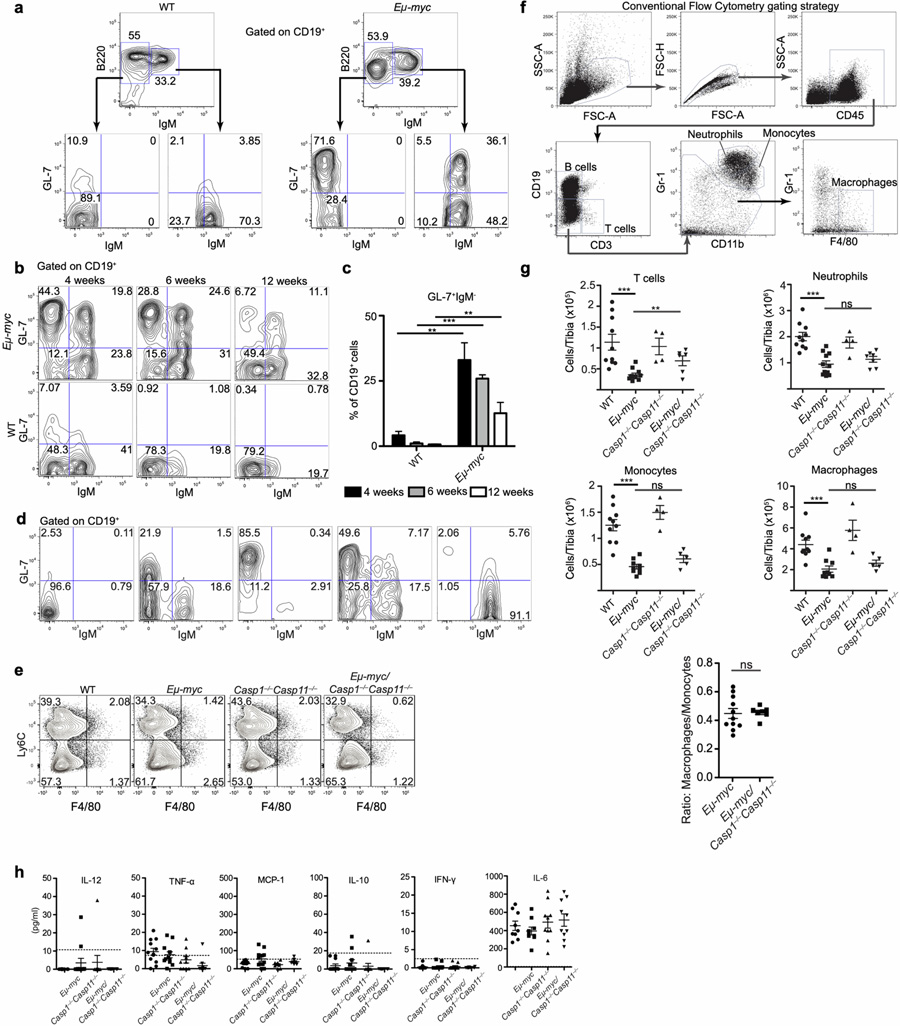
圖2 GL-7和IgM表達的分析有助于描述循環中癌前和惡性Eμ-myc B細胞的特征
 |
 |
 |
| 官網:www.baichuan365.com | 微信服務號:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信訂閱號:seebiotech | 泉養堂:www.canmedo.com |
相關資訊
- Ludger高通量甲基化檢測方法
- 西寶生物參加單仁電子商務學院整體輸出班
- 「西寶生物」隆重推出【KroVin300生物防腐劑】,用于體外診斷試劑生產,廣譜!高效!安全!
- 心血管疾病和腎病研究用Elisa試劑盒
- Wako MagCapture系列磁珠捕獲用磁力架
- hPSC 解離溶液
- CT掃描可能增加兒童患腦腫瘤的風險
- 2013年山東青島威海旅游合影
- NLRP3抗體 anti-NLRP3/NALP3, mAb
- 科學家在細胞外“重演”細胞分裂
新進產品
同類文章排行
- Nature子刊:炎性體保護干細胞免于癌變
- Science先進技術揭示治療性單克隆抗體與CD20分子相互作用機制
- 《Nature》單胺類神經遞質對大腦結構不為人知的作用機制
- 一種以前未知的機制:當細胞的DNA受損時,這種機制會引發細胞的炎癥免疫反應
- Nature子刊:耐藥細菌的一個“鋅”弱點
- Broad研究所創建了一種新的方法來靶向和糾正與疾病相關的蛋白質
- Science:一類全新的抗瘧疾抗體
- 《Nature》脂肪肝為什么會導致肝癌?
- Nature:癌癥轉移時為何青睞肺部?
- 《Nature Biomedical Engineering》疼痛研究新突破:一種更安全、不會上癮的方法
資訊文章
您的瀏覽歷史