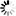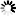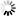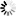摘要:研究表明,如果沒有對DNA損傷做出第一反應的人,端粒酶是如何肆無忌憚地給受損的DNA封頂的。
染色體的自然末端有時會出現斷裂的DNA,但這就像是斷開的意大利面很難和完整的面條區分開來一樣,要想檢測出斷裂的DNA,并不是那么容易。不過我們體內的每個細胞都有一種方法來區分這兩者,因為保護染色體健康末端的最佳方法,恰好也是修復受損DNA的最糟糕方法。
首先考慮到端粒酶,這種酶負責維持染色體自然末端的保護性端粒。如果端粒酶用端粒把斷裂的DNA鏈封閉起來,它就會阻止斷裂的DNA鏈進一步修復,并刪除必要的基因。最近,《科學》雜志上的一項新研究描述了細胞是如何避免這種意外的。這些發現表明,多虧了一種稱為ATR激酶(一種對DNA損傷作出反應的關鍵酶)的作用,否則端粒酶真的會肆無忌憚地將端粒添加到受損的DNA上。
 圖1 ATR阻止端粒酶將DNA斷裂轉化為端粒
圖1 ATR阻止端粒酶將DNA斷裂轉化為端粒“端粒酶是個好東西,因為它能維持我們的端粒,但它只應該在染色體的自然末端起作用。如果它在雙鏈DNA斷裂處起作用,那將是非常糟糕的,因為它可能導致斷裂處遠端所有基因的丟失,端粒酶的這種有害方面受到ATR激酶的抑制,而ATR激酶具有許多功能,也能阻止端粒酶進入。”洛克菲勒大學蒂Titia de Lange教授說。
這一發現可能有助于優化CRISPR技術,并可能為癌癥研究提供信息。
酶vs酶
1990年,《自然》(Nature)雜志上的一項研究報告稱,一名α-地中海貧血癥患者的DNA末端斷裂,端粒DNA被添加到其中。這是端粒酶可以在缺乏適當控制的情況下對受損DNA起作用的最早報道。
但端粒酶是否是導致端粒失控的罪魁禍首,以及健康細胞是如何防止端粒失控的,目前仍不清楚。de Lange實驗室的醫學博士Charles Kinzig在文獻中搜索了類似的案例,并著手確定端粒酶是否是罪魁禍首。
Kinzig和他的同事們首先使用CRISPR基因編輯工具Cas9 來切割人類DNA片段,并確定端粒酶在斷裂的DNA上產生“neotelomeres”。在確定端粒酶驅動新端粒形成之后,Kinzig開始研究各種分子途徑,確定在正常情況下是什么阻止端粒酶干擾DNA修復。他最終發現,破壞ATR激酶信號會增加新端粒的形成,并證明當ATR在DNA斷裂處被激活時,它會阻止端粒酶破壞修復。
“這是端粒酶和ATR之間的一場競賽,”Kinzig說。端粒酶需要DNA末端來形成單鏈底物。但與此同時,單鏈DNA也是激活ATR的關鍵。
從CRISPR到癌癥
這些發現對參與CRISPR基因編輯的研究人員和臨床醫生具有直接意義。
Kinzig和同事們發現端粒酶可以將端粒DNA添加到CRISPR編輯過程中產生的DNA末端。這可能會導致端粒DNA的插入,或者在CRISPR編輯的位置形成端粒。“CRISPR領域現在意識到了這一點,可以采取措施防止這種不想要的結果”。
從長遠來看,該實驗室計劃關注這些發現與癌癥的關系。端粒酶在大多數人類癌癥中被激活,人們認為這有助于癌癥維持它們的端粒,從而有效地變得不死。
Kinzig和de Lange推測,新端粒的形成可能允許癌癥能夠容忍產生斷裂染色體的過程,例如BRCA1的缺陷。“我們現在正在測試新端粒的形成是否確實有助于細胞處理困擾癌細胞的基因組不穩定性,我們拭目以待,還有很多東西需要學習。”
與此同時,Kinzig正在完成他的醫學訓練,為下一步做準備。“他的論文研究非常優秀,部分原因是他涉足了我的實驗室從未涉足過的領域。”de Lange說。
參考資料
[1] ATR blocks telomerase from converting DNA breaks into telomeres
 |
 |
 |
| 官網:www.baichuan365.com |
微信服務號:iseebio |
微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn |
微信訂閱號:seebiotech |
泉養堂:www.canmedo.com |