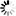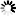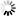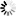通過腸道淋巴系統吸收?!藥物吸收新途徑 靶向小鼠癌細胞
摘要:密歇根大學一個研究小組正在開發一種新的抗癌藥物,這種藥物通過腸道的淋巴系統而不是血管吸收,有可能戰勝導致耐藥性的分子信號通路,同時提高抗癌能力和減少副作用。非常值得留意。
密歇根大學(University of Michigan)的一個研究小組正在開發一種新的抗癌藥物,這種藥物通過腸道的淋巴系統而不是血管吸收,有可能戰勝導致耐藥性的分子信號通路,同時提高抗癌能力和減少副作用。今天發表在《Nature Communications》的一項研究報告了一種新型激酶抑制劑,它能顯著降低骨髓纖維化(急性白血病的前兆)小鼠的疾病,延長生存期。
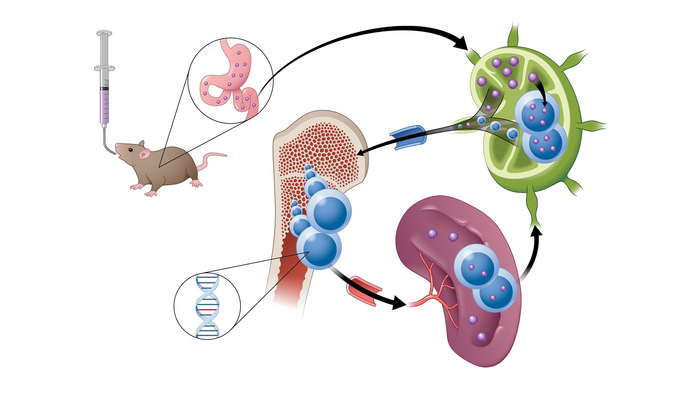
圖:展示這種新型藥物如何通過淋巴系統被吸收的模型
來源:DANIELLE DOBBS/MICHIGAN MEDICINE/密歇根醫學院
“癌癥的聯合療法經常受到劑量限值毒性的困擾。盡管預計通過胃腸道淋巴系統吸收和轉運的藥物吸收途徑能有助于避免肝臟首關代謝、改善藥物暴露、減少劑量限值毒性、維持藥物水平、提高全身生物利用度,但一直以來很少有這方面的探索。(首關代謝指藥物從消化道吸收,隨血流進入肝臟再到達血循環的過程中,因在肝臟等部位受酶的作用而被代謝分解,喪失部分藥效(效價),使進入體循環的有效藥量減少的效應。這種效應明顯降低了藥物的口服生物利用度。)部分原因可能是對淋巴吸收而非門靜脈吸收的小分子所需的化學和藥代動力學特性的理解有限。先前證明可實現淋巴吸收的小分子包括維生素 D3 和 E 、合成大麻素等。
利用合成藥物化學和計算對接研究,密歇根大學的研究人員報告了一種針對 PI3K 和 MAPK 信號通路的強效選擇性、口服生物可利用的單分子多功能激酶抑制劑 (LP-182) 的開發。LP-182 獨特的理化性質使之在口服后可實現淋巴吸收——通過在腸系膜淋巴系統中的隔離可使得全身血液循環中藥物和活性代謝物水平增加,提高了整體生物利用度并減少了可觀察到的毒性。
磷酸肌醇3激酶(PI3K)和絲裂原活化蛋白激酶(MAPK)這兩種分子信號通路驅動多種癌癥,是實體惡性腫瘤中改變最多的致癌信號通路之一,由于靶點抑制不足、代償性信號激活和下游靶點趨同,使用單通路抑制劑的臨床效率一直很差。即使一種藥物阻斷了一個通路,另一個通路也可以提供一個逃逸生存通路來補償和繼續生長。
LP-182 在體外和體內均實現了對 PI3K 和 MAPK 信號通路的選擇性有效抑制。口服給藥導致血漿半衰期延長,這歸因于LP-182首先被腸道淋巴系統中活性脂蛋白轉運途徑吸收。淋巴系統作為一個儲存庫,將藥物從身體的其他部分隔離出來,并隨著時間的推移逐漸將藥物釋放到全身循環中,以保持藥物濃度在最佳治療水平。
骨髓纖維化(MF)是一種明顯累及繼發性淋巴器官(如脾臟)的血液腫瘤。骨髓纖維化主要源于造血干細胞和祖細胞(HSPCs)的突變激活了JAK2激酶。在骨髓纖維化中,骨髓中會形成過多的疤痕組織,破壞正常的血細胞生成。過度活躍的分子信號傳導導致惡性干細胞增殖、廣泛纖維化、脾臟腫大和進行性骨髓衰竭。標準治療JAK2抑制劑(Ruxolitinib, Fedratinib)的耐藥性已被證明是代償性PI3K和MAPK生存信號同時激活的結果。
在骨髓增生性白血病癌基因(MPLW515L)小鼠骨髓纖維化(MF)模型的臨床前研究表明,LP-182可改善脾腫大和纖維化疾病表型、延長總生存期。MPLW515L小鼠模型口服LP-182還可導致骨髓和分離脾細胞中血液細胞數量的恢復,以及下游蛋白激酶B (PKB/AKT)和細胞外信號調節蛋白激酶1/2 (ERK1/2)信號活性的減弱。
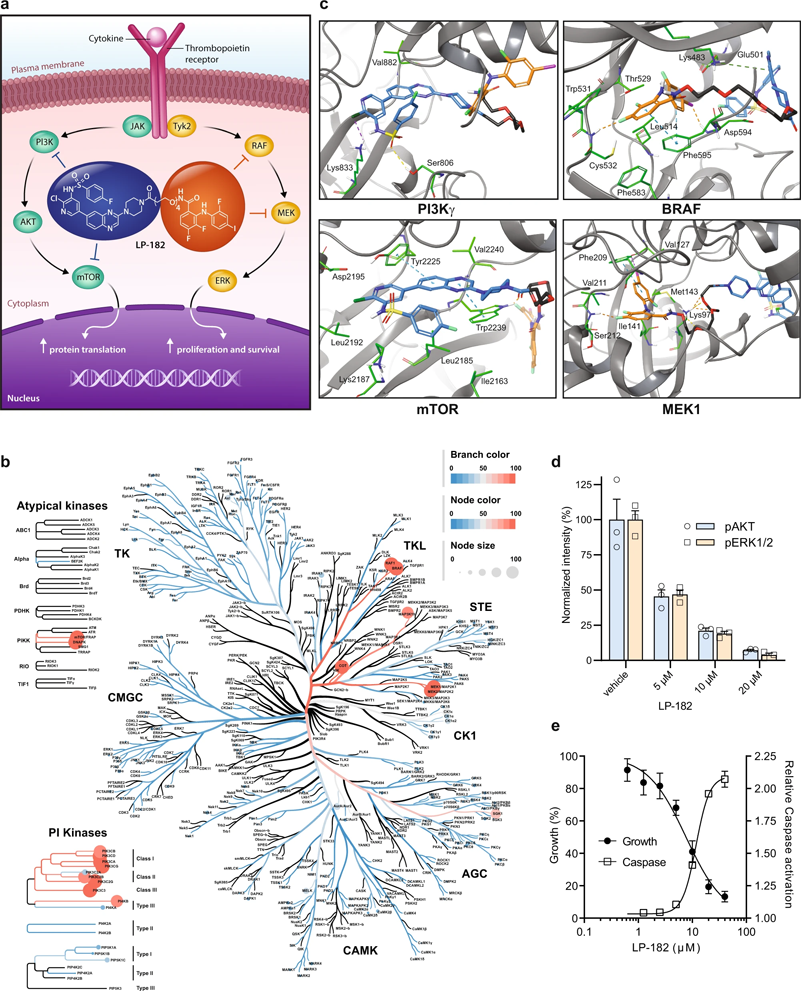
多功能激酶抑制劑LP-182表現出的選擇性和特異性
癌癥治療通常涉及針對不同癌細胞弱點的綜合治療。密歇根大學醫學院放射學研究教授、第一作者Brian D. Ross博士說,由于這些藥物在體內循環、被人體吸收和移除的速度不同,在限制藥物毒性和副作用的同時維持每種藥物在有效的必要濃度下的正確治療平衡可能是一項挑戰。
“在治療窗口內,我們能夠保持對這兩種不同但能相互補償的信號通路的靶向抑制,”Ross說,“這證明了將抗癌藥物直接輸送到淋巴系統的可行性,這為改善癌癥治療結果和減少藥物本身的副作用打開了巨大的新機會。”
骨髓纖維化通過淋巴組織傳播,這也是癌癥轉移的常見途徑,因此Ross和他的團隊的發現可能為防止癌癥擴散提供新的策略。此外,Ross說,因為腸道的淋巴系統容納了超過一半的身體免疫細胞,這項研究的結果可以為治療自身免疫性疾病和其他疾病提供方法。
Ross和他的同事將繼續擴大LP-182的臨床前研究,目標是在人類骨髓纖維化患者中開展一期臨床試驗。他們還在開發更多的淋巴靶向激酶抑制劑,用于治療實體腫瘤,包括乳腺癌、腦癌、胃腸道和胰腺癌,以及狼瘡和多發性硬化癥等自身免疫性疾病。
該研究最大的亮點在于證明了制備經由淋巴吸收多靶點激酶抑制劑的合成方案,以及對淋巴吸收中心的物理化學特征的表征,為推進經由淋巴吸收的小分子療法在人類疾病治療中的應用提供了一條途徑。
參考資料:
[1]Brian D. Ross, Youngsoon Jang, Amanda Welton, Christopher A. Bonham, Dilrukshika S. W. Palagama, Kevin Heist, Jagadish Boppisetti, Kasun P. Imaduwage, Tanner Robison, Leah R. King, Edward Z. Zhang, Cyrus Amirfazli, Kathryn E. Luker, Winston Y. Lee, Gary D. Luker, Thomas L. Chenevert & Marcian E. Van Dort, A lymphatic-absorbed multi-targeted kinase inhibitor for myelofibrosis therapy, Nature Communications volume 13, Article number: 4730 (2022)
 |
 |
 |
| 官網:www.baichuan365.com | 微信服務號:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信訂閱號:seebiotech | 泉養堂:www.canmedo.com |
相關資訊
- Org Biomol Chem:對嘧啶核苷進行修飾產生具有抵抗HIV潛力的化合物
- 3D打印生物陶瓷支架表面微納米結構調控骨-軟骨一體化修復研究獲進展
- 科學家鑒別出飲食壓力狀態下支持血細胞產生的特殊分子
- Nature:首次揭示軍團菌毒素SidJ劫持人鈣調蛋白并促進這種細菌茁壯成長機制
- 乳化活性納米鐵
- 首個臨床試驗! 科學家利用異體造血干細胞來治療阿爾茲海默氏癥
- Galacturonan 半乳糖醛酸/ Apiogalacturonan 芹半乳糖醛酸 - Elicityl生物質提取天然多糖和寡糖產品(10)
- 新型生物表面活性劑 - 槐糖脂(sophorolipid)
- Mol Cancer Res:鑒別出關鍵靶點有望開發出治療三陰性乳腺癌的新型療法
- 價格戰烽煙再起,天價藥還能風光多久?
新進產品
同類文章排行
- 清除人體內衣原體感染的關鍵鑰匙
- iScience:一種對抗遺傳性神經系統疾病的潛在途徑
- 真的有可以中和所有已知COVID-19毒株的抗體?
- 細胞“廢物”使抗癌的免疫細胞恢復活力!
- 男性注意!這種食品攝入過多會導致結直腸癌
- 無路可退!主食中的農藥殘留,可誘發阿爾茨海默病
- Cell出乎意料新發現:原來是這種“瀕死體驗”讓癌細胞惡化
- 研究發現,冠狀病毒的形狀會影響其傳播
- Science Advances新突破:快速高效生產人體免疫細胞的新方法
- 《Nature Genetics》確定10個克羅恩病相關基因
資訊文章
您的瀏覽歷史