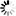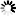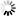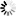摘要:EPFL的科學(xué)家們重現(xiàn)了在患有盧伽雷氏病和其他神經(jīng)系統(tǒng)疾病的患者的大腦中發(fā)現(xiàn)的病理蛋白聚集體的關(guān)鍵特征
EPFL的科學(xué)家們重現(xiàn)了在患有盧伽雷氏病和其他神經(jīng)系統(tǒng)疾病的患者大腦中發(fā)現(xiàn)的病理蛋白聚集體的關(guān)鍵特征,為潛在的機(jī)制提供了見解,并為新療法提供了有希望的途徑。研究結(jié)果發(fā)表在《Nature Neuroscience》雜志上。
 圖1 科學(xué)家們重現(xiàn)了在患有盧伽雷氏病和其他神經(jīng)系統(tǒng)疾病的患者大腦中發(fā)現(xiàn)的病理蛋白聚集體的關(guān)鍵特征
圖1 科學(xué)家們重現(xiàn)了在患有盧伽雷氏病和其他神經(jīng)系統(tǒng)疾病的患者大腦中發(fā)現(xiàn)的病理蛋白聚集體的關(guān)鍵特征一些神經(jīng)退行性疾病,如阿爾茨海默氏癥、帕金森氏癥和肌萎縮性側(cè)索硬化癥(ALS),都是由蛋白質(zhì)偏離方向并開始聚集成原纖維而引起的,這些原纖維積聚在特定的大腦區(qū)域。現(xiàn)在,EPFL的科學(xué)家們發(fā)現(xiàn)了一種新的機(jī)制,可以解釋聚集體是如何變得病態(tài)并擴(kuò)散到大腦的不同區(qū)域的。一個(gè)主要的懷疑是一種叫做TDP43的高度不穩(wěn)定的蛋白質(zhì)。科學(xué)家們發(fā)現(xiàn),在大腦中形成的TDP43聚集體在經(jīng)過處理以顯示其“粘性”核心之前并不是隱性致病的。
TDP43蛋白的聚集是ALS和其他神經(jīng)退行性疾病的標(biāo)志。一旦形成,TDP43聚集體可以擴(kuò)散到不同的大腦區(qū)域,在那里它們破壞正常和功能的TDP-43。但是首先是什么觸發(fā)了TDP-43的聚集呢?釋放其致病作用的機(jī)制是什么?這種知識(shí)差距阻礙了阻斷TDP-43聚集或中和其毒性的有效藥物的開發(fā)。
通過裂解釋放TDP43的致病作用
在這項(xiàng)最新的EPFL研究中,Senthil Kumar博士和Hilal Lashuel教授與賓夕法尼亞大學(xué)的科學(xué)家合作,發(fā)現(xiàn)了一種新的機(jī)制,負(fù)責(zé)釋放TDP43聚集體的致病作用,這些聚集體在試管中制備或從死后患者的大腦中分離出來。這些TDP43聚集體的表面必須首先被酶切割,以顯示隱藏的粘性表面,這些粘性表面吸引正常的TDP-43蛋白并誘導(dǎo)形成更多的聚集體。
該論文的第一作者Senthil T. Kumar博士說:“我們有能力在實(shí)驗(yàn)室中開發(fā)出一種生產(chǎn)原纖維的新方法,這促進(jìn)了這一發(fā)現(xiàn),這種原纖維與ALS患者大腦中的原纖維具有相同的形態(tài)和結(jié)構(gòu)特征。”
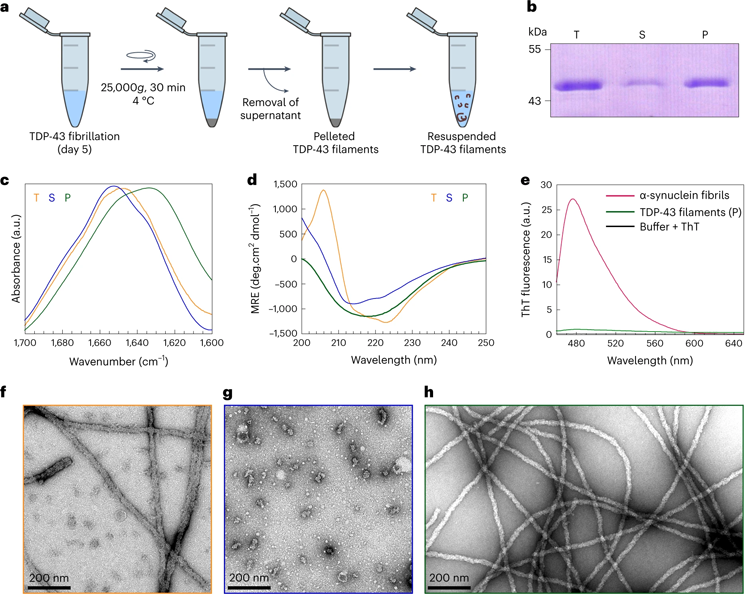 圖2 FL TDP-43纖維的制備及結(jié)構(gòu)表征
圖2 FL TDP-43纖維的制備及結(jié)構(gòu)表征使用低溫電子顯微鏡,在通過電子顯微鏡觀察之前,樣品被低溫冷凍,研究人員發(fā)現(xiàn)TDP-43細(xì)絲被埋在一個(gè)更大的細(xì)絲中,并且是不可接近的,也就是說,還不是病理的,因?yàn)樗鼈儽坏鞍踪|(zhì)的球狀部分覆蓋。只要這些細(xì)絲被埋在地下,它們就以隱身模式存在,其他分子或蛋白質(zhì)無法接近。換句話說,當(dāng)TDP43的外部涂層被切開,露出其“粘性”的內(nèi)部細(xì)絲時(shí),它就會(huì)變得病態(tài),而當(dāng)其外部涂層完好無損時(shí),它仍處于隱身模式。
“我們的研究結(jié)果表明,抑制負(fù)責(zé)切割TDP-43纖維的酶是一種可行的治療策略,可以減緩TDP-43聚集體的形成,防止它們?cè)诖竽X中擴(kuò)散,從而減緩疾病的進(jìn)展。下一步,我們計(jì)劃鑒定這些酶,并確定抑制它們的活性是否可以防止細(xì)胞和動(dòng)物ALS模型中的TDP-43聚集和神經(jīng)退行性變,”EPFL教授Hilal Lashuel說,他領(lǐng)導(dǎo)了這項(xiàng)研究的實(shí)驗(yàn)室。
新的結(jié)果也對(duì)開發(fā)新的工具和方法來早期診斷ALS和其他神經(jīng)退行性疾病有意義。保護(hù)的球狀層可以解釋為什么TDP-43原纖維如此難以檢測。通常用于檢測和監(jiān)測腦中其他可疑蛋白形成的原纖維的標(biāo)準(zhǔn)方法和染料通常無法檢測到TDP-43原纖維。“這也解釋了為什么使用完整的TDP-43原纖維開發(fā)顯像劑非常具有挑戰(zhàn)性。迫切需要這樣的顯像劑來實(shí)現(xiàn)早期診斷、監(jiān)測疾病進(jìn)展和評(píng)估新療法的療效,”Kumar博士說。
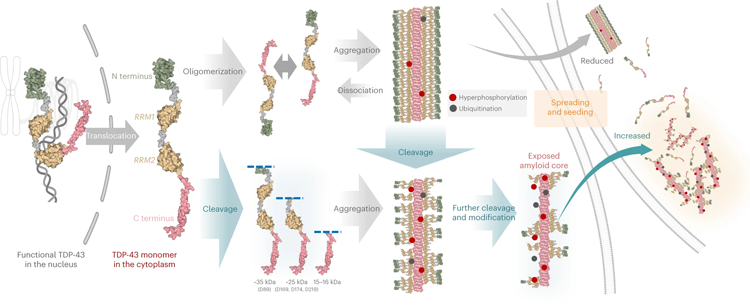 圖3 一種形成TDP-43原纖維的機(jī)制模型
圖3 一種形成TDP-43原纖維的機(jī)制模型研究全長蛋白的重要性
TDP-43是一種高度不穩(wěn)定的蛋白質(zhì),可以快速聚集成不同的結(jié)構(gòu),因此以可重復(fù)的方式產(chǎn)生類似病理的TDP-43聚集體具有挑戰(zhàn)性。這迫使許多科學(xué)家研究蛋白質(zhì)的小片段,特別是來自負(fù)責(zé)驅(qū)動(dòng)其聚集的區(qū)域的片段。Kumar博士說:“當(dāng)我們確定在實(shí)驗(yàn)室中制備的TDP-43原纖維核心的蛋白質(zhì)片段的結(jié)構(gòu)時(shí),我們獲得了與從患者大腦中分離的TDP-43原纖維不同的結(jié)構(gòu),盡管這些片段的氨基酸序列實(shí)際上是相同的。”
Hilal Lashuel說:“我們的研究結(jié)果表明,易聚集區(qū)域兩側(cè)的蛋白質(zhì)序列在決定最終結(jié)構(gòu)方面起著重要作用,而且在大腦中重現(xiàn)TDP-43聚集物的特性需要與全長蛋白質(zhì)一起工作。這對(duì)于確保我們?cè)趯?shí)驗(yàn)室開發(fā)的藥物、抗體和顯像劑有更高的機(jī)會(huì)參與患者大腦中與疾病相關(guān)的TDP-43聚集體至關(guān)重要。”
研究人員表明,他們可以生產(chǎn)出與患者大腦原纖維具有相同核心序列的TDP-43原纖維。Hilal Lashuel說:“但我們?nèi)匀恍枰_定未被掩蓋的原纖維核心是否具有相同的結(jié)構(gòu)。如果我們證明了這一點(diǎn),那么我們將擁有唯一一個(gè)允許在試管中產(chǎn)生實(shí)際病理的系統(tǒng)。這將對(duì)了解疾病相關(guān)突變和蛋白質(zhì)修飾如何影響TDP-43聚集具有重大意義,并將促進(jìn)開發(fā)阻斷TDP-43聚集、中和其致病性或與TDP-43聚集結(jié)合并促進(jìn)其在大腦中的檢測的新藥。”
參考資料:
[1] Seeding the aggregation of TDP-43 requires post-fibrillization proteolytic cleavage